在实验室里模拟工业用钛铁矿(FeTiO3)提取钛主要过程如下:
步骤1:在加热条件下,用硫酸溶解10.0g钛铁矿,将TiO32-转化为TiO2+,还生成FeSO4;
步骤2:利用降温结晶法,使得绿矾析出,滤出绿矾后,加热滤液水解得到钛酸(H2TiO3)沉淀,将钛酸进行焙烧制得TiO2.
步骤3:TiO2+C+Cl2
TiCl4+CO(未配平)△
步骤4:TiCl4(g)+Mg(g)→Ti(s)+MgCl2(l)(未配平)
请结合上述信息完成下列问题:
(1)写出步骤1的化学反应方程式:______;该反应______(填“是”或“不是”)氧化还原反应.
(2)配平步骤3的化学反应方程式,并标出电子转移的方向和数目.TiO2+C+Cl2
TiCl4+CO______△
(3)步骤3的反应中还原产物是______.
(4)上述过程中参加反应的金属镁为1.2g,假设实验过程中无损失,则该钛铁矿中FeTiO3的质量分数为______.
(1)反应物有FeTiO3、H2SO4,生成物有:TiOSO4和FeSO4,化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O,元素的化合价都未发生变化,
故答案为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O;不是;
(2)TiO2+C+Cl2
TiCl4+CO,C中C元素化合价由0价升高为为+2价,1个CO化合价变化为2,Cl2中氯元素化合价由0价降低为-1价,1个TiCl4化合价变化为4,根据电子守恒,TiCl4的系数为1,CO的系数是2,再根据质量守恒得:TiO2+2C+2Cl2△
TiCl4+2CO,元素化合价升高值等于元素化合价降低值=电子转移数=4,电子转移情况为:△ .
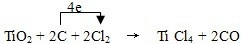 ,故答案为:
,故答案为: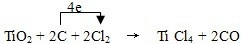 ;
;
(3)Ti元素的化合价由+4价降低为0价,是氧化剂,得到还原产物 TiCl4,故答案为:TiCl4;
(4)金属镁的物质的量为
=0.05mol,由FeTiO3~TiO2~TiCl4~2Mg,得FeTiO3的物质的量为0.025mol,FeTiO3的质量为0.025mol×152g/mol=0.038g,所以钛铁矿中FeTiO3的质量分数1.2g 24g/mol
×100%=38%,故答案为:38%.0.038g 10.0g
