“84消毒液”与硫酸溶液反应可以制取氯气(NaClO+ NaCl+H2SO4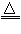 Na2SO4 + Cl2↑+H2O)为探究氯气的性质,某同学设计了如下所示的实验装置
Na2SO4 + Cl2↑+H2O)为探究氯气的性质,某同学设计了如下所示的实验装置

请回答:
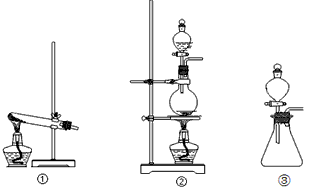
(1)从①、②、③装置中选择合适的制气装置(A处)__________(填写序号)。
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是__________,说明该装置存在明显的缺陷,请提出合理的改进的方法____________________。
(3)为了验证氯气的氧化性,将氯气通Na2SO3溶液中,写出氯气与Na2SO3溶液反应的离子方程式____________________
(4)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有__________。
(5)写出氯气与氢氧化钠溶液反应的化学方程式____________________,为验证尾气吸收后的溶液中存在氯离子,正确的操作为____________________。
(1)②
(2)产生的氯气中含有水蒸气会反应生成次氯酸;在装置A、B之间增加盛有浓硫酸的洗气瓶(或干燥装置)
(3)Cl2 + SO32-+ H2O = SO42- + 2Cl-+ 2H+
(4)HCl(或盐酸)
(5)Cl2+2NaOH=NaCl+NaClO+H2O;取少量反应后的溶液于试管中,向其中先加入足量的稀硝酸,再加入硝酸银溶液,若出现白色沉淀,则原溶液中含有Cl-
