问题
实验题
I:某兴趣小组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如下图实验装置。请回答:
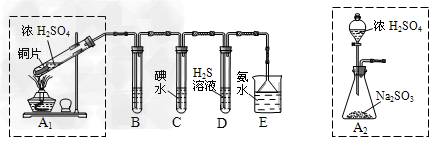
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为_________;C中反应的离子方程式为________________。
(2)为了实现绿色环保的目标,某同学设计了上图A2的制取装置来代替A1装置,与A1装置相比, A2装置的优点是_____________(写2点)。
II:用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。请回答:
(3)氨水吸收过量SO2的反应的离子方程式为________________。
(4)已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2 mol/L盐酸、2 mol/LHNO3、1 mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论

答案
(1)品红溶液;SO2 + I2 + 2H2O == SO42- +2I- +4 H+
(2)不用加热;相对安全;易于控制反应进行;反应更充分
(3)NH3·H2O + SO2 = NH4+ + HSO3-
(4)

