问题
实验题
下面的装置是仿照工业上制备硫酸的工艺流程设计出来的,用于探究工业上为何采用98.3%的浓硫酸吸收三氧化硫。
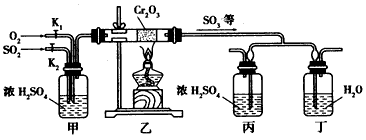
请回答下列问题:
(1)写出沸腾炉内煅烧黄铁矿的反应方程式__________________;
(2)甲和乙相当于工业上制取硫酸装置中的_______________;
(3)写出在催化剂表面所发生反应的化学方程式_______________,在实验过程中不能持续加热的理由是
___________;
(4)在乙反应器内要求氧气的量要比二氧化硫的量多一倍左右,你是如何控制和估计的?___________。
(5)若丁装置在反应过程中先出现气泡,不久就出现了雾,而丙装置一直都没有任何现象,产生这种现象的原因可能是__________
A.浓硫酸对三氧化硫的吸收效率远好于水,三氧化硫被浓硫酸充分吸收
B.三氧化硫的通气速率太快,三氧化硫未被水和浓硫酸充分吸收
C.丙中的导气管插得太深,导致两个吸收瓶内的气压差较大
D.丁中的导气管插得太浅,三氧化硫气体从水中逸出,与水蒸气化合形成酸雾
答案
(1)4FeS2+11O2 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)接触室
(3)2SO2+O2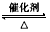 2SO3;防止温度过高,而降低SO2的转化率及催化剂活性
2SO3;防止温度过高,而降低SO2的转化率及催化剂活性
(4)可以通过调节气阀,控制气体流量,观察甲装置的冒泡速率进行估算
(5)AC
