问题
实验题
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。
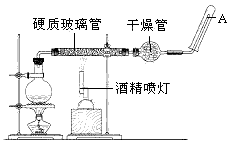
请回答该实验中的问题。
(1)写出该反应的反应方程式:________________ ;并指明该氧化还原反应的还原剂是_________ ,氧化剂是__________ ,假设有1mol氧化剂参加反应,转移的电子数的物质的量为____________ 。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是_____________ ;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是_______________ 。
(3)酒精灯和酒精喷灯点燃的顺序是 ,为什么?__________________ 。
(4)干燥管中盛装是的物质是_____________ ,作用是_______________ 。
(5)某次实验后,取硬质玻璃管中的固体物质少量,溶于足量稀盐酸,再滴加KSCN溶液。溶液颜色无明显变化,试解释原因 ___________________。
答案
(1)3Fe+4H2O(g)=== Fe3O4+4H2 ;Fe;H2O;2mol
(2)为硬质玻璃管内Fe与水蒸气的反应实验提供持续不断的水蒸气;防止暴沸
(3)先点酒精灯,再点酒精喷灯;防止先点燃酒精喷灯所导致的Fe与O2的反应。
(4)碱石灰干燥剂;除去反应产生的H2中的水蒸气。
(5)过量的铁与生成的Fe3+反应生成Fe2+,故加入KSCN溶液后颜色无明显变化
