镍电池由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境 有危害,某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
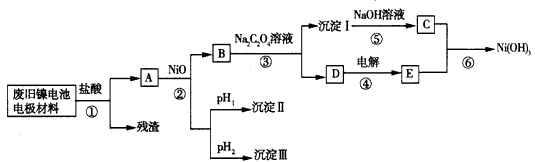
已知:
①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②某温度下一些金属氢氧化物的Ksp及沉淀析出的理论pH如下表所示:

回答下列问题:
(1)根据上表数据判断步骤②依次析出沉淀Ⅱ:____和沉淀Ⅱ:____(填化 学式),则pH1____pH2(填“>”、“=”或“<”)。
(2)已知溶解度:NiC2O4>NiC2O4·H2O> NiC2O4·2H2O,则步骤③中反应的化学方程式是_______。第③步反应后,过滤沉淀I所需的玻璃仪器有___。
(3)步骤④中阳极反应产生的气体E为一黄绿色气体,写出步骤⑥中反应的离子方程式___
(4) FeCl3和AlCl3的混合溶液中加入NaOH溶液,若Fe(OH)3和Al(OH)3同时存在,则 c(Fe3+)/c(Al3+)=____。
(1)Fe(OH)3 ;Al(OH)3 ;<
(2) NiCl2 +Na2C2O4+2H2O=NiC2O4·2H2O↓+2NaCl ;烧杯、漏斗、玻璃棒
(3)2Ni(OH)2 +2OH-+Cl2= 2Ni(OH)3 +2Cl-
(4)2×10-5
