某化学兴趣小组欲研究一种镁铝合金,以下是部分实验。请完成填空。
【实验一】从镁铝合金片上剪下一小块,先称重,然后投到盛有10 mL 10 mol·L-1 NaOH溶液(足量)的锥形瓶里。实验测得不同时刻气体体积如下图:
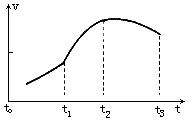
(1) t0~t1过程中速率比t1~t2速率____(填“快”或“慢”),其主要原因是___。
(2)影响过程t1~t2速率的主要原因是:①___, ②___。
(3)欲利用此反应测定合金中铝的含量,请仿照方法①将另一种不同方法所需数据填入下表。

【实验二】向实验一的锥形瓶里滴加1 mol.L-1 HCl,使镁、铝两种元素恰好只以氯化物的形式存在。写出此过程中含铝元素的化合物所发生的离子反应方程式:____。
【实验三】取实验二的锥形瓶里的溶液10 mL,向其中滴加a mLc1mol.L-1 NaOH之后,改成滴加 c2mol.L-1HCl,所得沉淀y(mol)与试剂总体积 V(mL)间的关系如下图所示。据此,回答下列问题:
(1)图中CD段消耗盐酸的体积是AB段消耗的 NaOH溶液体积的两倍,则c1/c2=____,
(2)所加入NaOH溶液的体积a=____mL。

【实验一】(1)慢 ;合金表面有氧化膜
(2)①形成原电池;②反应放热,温度升高
(3)②“测定残留固体镁的质量”或“测定反应消耗或剩余的NaOH的量”或“测定生成的NaAlO2的量” 【实验二】AlO2-+4H+=Al3+ +2H2O
【实验三】(1)2或2:1;
(2)7
