工业上从废铅蓄电池的铅膏回收铅的过程中,可用碳酸盐溶液与处理后的铅膏(主要成分为
PbSO4)发生反应:PbSO4(s)+CO32-(aq) PbCO3(s)+SO42-(aq)某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
PbCO3(s)+SO42-(aq)某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分。
(1)上述反应的平衡常数表达式:K= __________
(2)室温时,向两份相同的PbSO4样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在__________溶液中PbSO4转化率较大,理由是____________________
(3)查阅文献:上述反应还可能生成碱式碳酸铅铅[2PbCO3·Pb(OH)2],它和PbCO3受热都易分解生成PbO。该课题组对固体产物(不考虑PbSO4)的成分提出如下假设,请你完成假设二和假设三:
假设一:全部为PbCO3;假设二:__________假设三:__________
(4)为验证假设一是否成立,课题组进行如下研究。
①定性研究:请你完成下表中内容。
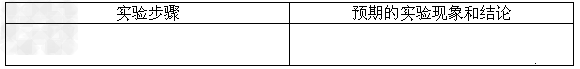
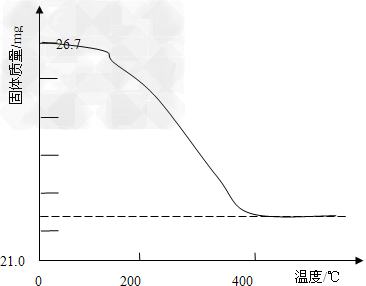
②定量研究:取26.7mg的干燥样品,加热,测得固体质量随温度的变化关系如下图。某同学由图中信息得出结论:假设一不成立。你是否同意该同学的结论,并简述理由:
____________________。
(1)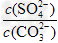
(2) Na2CO3;相同浓度的Na2CO3和NaHCO3溶液中,前者c(CO32-)较大
(3)全部为PbCO3·Pb(OH)2;PbCO3与PbCO3·Pb(OH)2的混合 物
⑷ ①
②同意,若全部为PbCO3,26.7 g完全分解后,其固体质量为22.3 g (或不同意,实验最终得到固体的质量与全部为PbCO3分解所得固体质量相差不大,可能是实验过程中产生的误差引起的)
