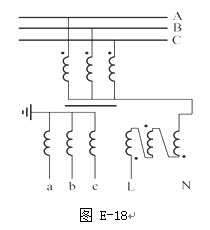
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和Ca,并含有3.5%(质量分数)CaO
(1)Ca元素在周期表中位置是______,其原子结构示意图______.
(2)Ca与最活跃的非金属元素A形成化合物D,D的电子式为______,D的沸点比A与Si形成的化合物E的沸点______.
(3)配平用钙线氧脱鳞的化学方程式:______P+______FeO+______CaO→______Ca3(PO4)2+______Fe
(3)将钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n.则金属M为______;检测Mn+的方法是______(用离子方程式表达).
(5)取 1.6g钙线试样,与水充分反映,生成224ml H2(标准状况),在向溶液中通入适量的CO2,最多能得到CaCO3______g.
(1)Ca是20号元素,钙原子核外电子数为20,有3个电子层,各层电子数为2、8、8、1,处于周期表中第四周期第ⅡA族,原子结构示意图为
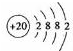
,故答案为:第四周期第ⅡA族;

;
(2)最活跃的非金属元素A为F元素,钙与氟形成氟化钙,为离子化合物,电子式为
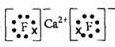
,氟元素与Si形成的化合物为SiF4,SiF4是分子晶体,离子晶体的沸点高于分子晶体,故沸点CaF2>SiF4;
故答案为:

;高;
(3)反应中P磷元素的化合价由0价升高为+5价,总共升高10价,铁元素化合价由+2价降低为0价,总共降低2价,化合价升高最小公倍数为10,故Ca3(PO4)2系数为1,FeO的系数为5,P系数为2,CaO的系数为3,Fe的系数为5,故配平后方程式为2P+5FeO+3CaO=Ca3(PO4)2+2Fe,故答案为:2、5、3、1、2;
(4)钙线试样溶于稀盐酸后,加入过量NaOH溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色M(OH)n,M为Fe元素,Fe3+与SCN-结合生成红色物质检验Fe3+,离子方程式为Fe3++3SCN-=Fe(SCN)3,
故答案为:Fe;Fe3++3SCN-=Fe(SCN)3;
(5)224mlH2的物质的量为
=0.01mol,钙与水反应生成氢氧化钙与氢气,根据电子转移守恒可知,Ca的物质的量为0.224L 22.4L/mol
=0.01mol,样品中CaO质量分数为3.5%,故氧化钙的质量为1.6g×3.5%=0.056g,故氧化钙的物质的量为0.01mol×2 2
=0.001mol,氧化钙与水反应生成氢氧化钙,氢氧化钙与二氧化碳反应生成碳酸钙,根据钙元素守恒可知生成的n(CaCO3)=n(Ca)+n(CaO)=0.01mol+0.001mol=0.011mol,碳酸钙的质量为0.011mol×100g/mol=1.1g,0.056g 56g/mol
故答案为:1.1.