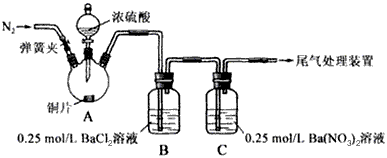
甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。
实验操作和现象

⑴A中反应的化学方程式是_______________。
⑵C中白色沉淀是__________,该沉淀的生成表明SO2具有____________性。
⑶C中液面上方生成浅棕色气体的化学方程式是____________________________。
⑷分析B中不溶于稀盐酸的沉淀产生的原因,甲认为是空气参与反应,乙认为是白雾参与反应。
①为证实各自的观点,在原实验基础上:甲在原有操作之前增加一步操作,该操作是______________;乙在A、B间增加洗气瓶D,D中盛放的试剂是______________。
②进行实验,B中现象
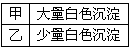
检验白色沉淀,发现均不溶于稀盐酸。结合离子方程式解释实验现象异同的原因:______________。
⑸合并⑷中两同学的方案进行实验。B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是____________________________。
⑴Cu+2H2SO4 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
⑵H2SO4;还原
⑶2NO+O2==2NO2
⑷①通N2一段时间,排除装置中的空气;饱和NaHSO3溶液;②甲:SO42-+Ba2+==BaSO4↓,
乙:2Ba2++2SO2+O2+2H2O==2BaSO4↓+4H+,白雾的量远多于装置中O2的量
⑸SO2与可溶性钡的强酸盐不能反应生成BaSO3沉淀
