问题
实验题
已知单质硫是淡黄色固体粉末,难溶于水。实验室制氯气的反应原理为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
MnCl2+Cl2↑+2H2O,为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:
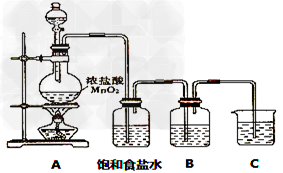
(1)已知:①硫酸比次氯酸稳定;②高氯酸比硫酸酸性强;③S2-比Cl-还原性强;④HCl比H2S稳定;⑤硫原子与氯原子电子层数相同,氯原子半径小于硫原子。可作为氯元素比硫元素非金属性强的依据的是______________ 。
A.②④ B.②③④⑤ C.②④⑤ D.全部
(2)装有饱和食盐水的洗气瓶的作用是 ______________
(3)装置B中盛放的试剂是______________(填选项),实验现象为____________ 。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)装置B中的溶液在实验后质量增重了0.78g,则在B中反应的气体为___________mol
(5)装置C中盛放烧碱稀溶液,目的是吸收剩余气体,防止污染空气。写出反应的离子方程式:____________________。
答案
(1)B
(2)为了除去气体中的HCl
(3)A ;生成淡黄色沉淀或溶液变浑浊
(4)0.02
(5)Cl2 +2OH-=Cl+ClO-+H2O
