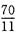问题
问答题
配平下列化学方程式______S+______ NaOH
______Na2S+______Na2SO3+______ H2O指出被氧化的元素是______,被还原的元素是______,氧化产物______,还原产物______,氧化剂与还原剂的质量比是______并用双线桥表示该反应转移的电子方向和数目______. △ .
答案
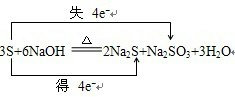
硫元素化合价既升高又降低,降低2价,升高4价,得失电子应相等,所以转移电子数为4,所以方程式为:3S+6NaOH
2Na2S+Na2SO3+3H2O,化合价升高元素是硫单质中的硫元素被氧化,所在的反应物硫是还原剂,对应产物Na2SO3是氧化产物,化合价降低元素是硫单质中的硫元素被还原,所在的反应物硫单质是氧化剂,对应产物Na2S是还原产物,所以氧化剂与还原剂的质量比是2:1,故答案为:3;6;2;1;3;S;S;Na2SO3;Na2S;2:1; △ .
.

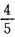 ,乙每天只能完成工作量的
,乙每天只能完成工作量的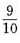 。现在要8天卖完这批衣服,两人合作的天数尽量少,那么两人合作多少天()
。现在要8天卖完这批衣服,两人合作的天数尽量少,那么两人合作多少天()