问题
实验题
一定量的浓H2SO4与足量的Zn充分反应时,有SO2和H2生成。某校化学研究性学习小组对此进行研究。
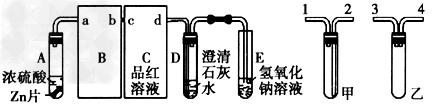
按图组装好实验装置,微热试管A,观察到C、D、E中均有气泡产生,随后气泡量减少,品红溶液褪色,D中先出现浑浊后浑浊消失;反应较长时间后,C、D、E中的气泡量又显著增加。试回答:
(1)装置A中需要用浓H2SO4,请用一种简单的方法确定一瓶H2SO4是浓H2SO4:_______________。
(2)从甲、乙中选择合适的装置填入B、C中,并进行正确连接,a接____、______接b,c接________、________接d。
(3)证明浓H2SO4具有强氧化性的实验现象为________________;反应较长时间后气泡又明显增加的原凶是________________。
(4)D中浑浊消失的离子方程式为_____________________。
(5)若要证明SO2具有还原性,C中的药品应该是_______________。
答案
(1)用火柴梗蘸取少量液体,若火柴梗立即变黑,证明是浓H2SO4(其他合理答案也可)
(2)3、4、2、1(或4、3、2、1)
(3)C中品红溶液褪色;浓H2SO4变为稀H2SO4后与 Zn反应放出H2
(4)SO2+H2O+CaSO3=Ca2++ 2HSO3-
(5)酸性KMnO4溶液或溴水
