某研究性学习小组为了证明在同温同压下,相同浓度相同体积的酸性不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定实验室条件下的气体摩尔体积.设计的简易实验装置如下图.
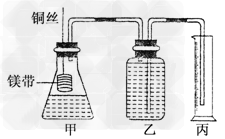
该实验的主要操作步骤如下:
①配制浓度均为1 mol/L盐酸和醋酸溶液;
②用________量取10.00 mL 1 mol/L盐酸和醋酸溶液分别加入到两个锥形瓶中;
③分别称取除去表面氧化膜的镁带a g,并系于铜丝末端,a的数值至少为________;
④在广口瓶中装足量的水,按图连接好装置;检查装置的气密性;
⑤将铜丝向下移动,使足量镁带浸入酸中(铜丝不与酸接触),至反应完全,记录________;
⑥反应结束后待温度恢复到室温,若丙中液面高于乙中液面,读取量筒中水的体积前,应________,读出量筒中水的体积为V mL.
请将上述步骤补充完整并回答下列问题:
(1)用文字表述④检查该装置气密性的操作: ______________________.
(2)本实验中应选用________(填序号)的量筒.
A.100 mL B.200 mL C.500 mL
(3)若水蒸气的影响忽略不计,在实验室条件下,气体摩尔体积的计算式为:Vm= ________.
(4)简述速率不等的原因 ___________________,铜丝不与酸接触的原因是_____________.
②酸式滴定管 ;③0.12 ;⑤反应起止时间 ;⑥将量筒缓缓向下移动,使乙、丙中液面相平
(1)两手掌紧贴锥形瓶外壁一会,如观察到广口瓶中长导管内有一段水柱升出液面,表明装置不漏气(只要表述明确、合理均可)
(2)B
(3) 0.2V L/mol
(4)酸的浓度相同时,c(H+)不同 ;防止形成的电池,干扰实验现象的观察
