CaCO3广泛存在于自然界,是一种重要的化工原料.大理石主要成分为CaCO3,另外有少量的含硫化合物.实验室用大理石和稀盐酸反应制备CO2气体.下列装置可用于CO2气体的提纯和干燥.
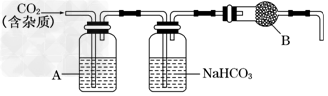
完成下列填空:
(1)用浓盐酸配制1∶1(体积比)的稀盐酸(约6 mol/L),应选用的仪器是________.
a.烧杯 b.玻璃棒 c.量筒 d.容量瓶
(2)上述装置中,A是________溶液,NaHCO3溶液可以吸收________.
(3)上述装置中,B物质是________.用这个实验得到的气体测定CO2的分子量,如果B物质失效,测定结果______(填“偏高”、“偏低”或“不受影响”).
(4)一次性饭盒中石蜡(高级烷烃)和CaCO3在食物中的溶出量是评价饭盒质量的指标之一,测定溶出量的 主要实验步骤设计如下:剪碎、称重→浸泡溶解→过滤→残渣烘干→冷却、称重→恒重为了将石蜡和碳酸钙溶出,应选用的试剂是________.
a.氯化钠溶液 b.稀醋酸 c.稀硫酸 d.正己烷
(5)在溶出量测定实验中,为了获得石蜡和碳酸钙的最大溶出量,应先溶出________,后溶出________.
(6)上述测定实验中,连续________,说明样品已经恒重.
(1)abc
(2)CuSO4溶液或酸性KMnO4溶液;HCl气体或酸性气体
(3)无水CaCl2;偏低
(4)bd
(5)石蜡;CaCO3
(6)两次称量的结果相差不超过(或小于)0.001 g
