工业上为从4J29合金(铁钴镍合金)废料中提取钴和镍,一般先用硫酸溶解合金,使其转化为Fe2+、Co2+、Ni2+,再把Fe2+氧化为Fe3+,从而使Fe3+转化为某种沉淀析出,达到与Ni2+、Co2+分离的目的.生产上要使Fe2+氧化为Fe3+,而不使Co2+、Ni2+氧化的试剂是NaClO或NaClO3(均含少量H2SO4)溶液.反应的部分化学方程式如下(A为还原剂):
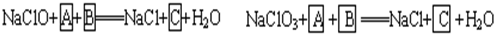
试回答下列问题:
(1)上述反应中,A为:______(写化学式,下同),C为:______.
(2)配平下列离子方程式:
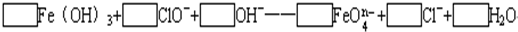
(3)已知有3.21g Fe(OH)3参加反应,共转移了5.42×1022个电子,则n=______,FeO
中铁的化合价为______. n-4
(4)根据(2)、(3)推测FeO
能与下列哪些物质反应(只填序号)______. n-4
A.Cl2 B.SO2C.H2S D.O2
(1)根据题意知,次氯酸钠和氯酸钠都是氧化剂,A是还原剂,则A失电子化合价升高,且溶液中含有硫酸,所以A中含有硫酸根离子且具有还原性,结合实验目的把Fe2+氧化为Fe3+从而使Fe3+转化为某种沉淀析出知,A是硫酸亚铁,B是硫酸,结合元素守恒知,C是硫酸铁,
故答案为:FeSO4,Fe2(SO4)3;
(2)该反应中铁元素的化合价+3→+(8-n),失去(5-n)个电子,氯元素的化合价+1→-1价,得到2个电子,得失电子的最小公倍数是2(5-n),所以氢氧化铁的计量数是2,次氯酸根离子的计量数是5-n,然后根据原子守恒配平方程式得
2Fe(OH)3+(5-n)ClO-+2nOH-=2 FeO4n-+(5-n)Cl-+(n+3)H2O,
故答案为2、5-n、2n、2、5-n、n+3;
(3)2Fe(OH)3+(5-n)ClO-+2nOH-=2FeO4n-+(5-n)Cl-+(n+3)H2O转移电子
214g 2(5-n)×6.02×1023
3.21g 5.42×1022
n=5-
=2,FeO42-中铁的化合价=-2-(-2)×4=+6,214×5.42×1022 3.21×2×6.02×1023
故答案为:2,+6;
(4)FeO42-中铁元素化合价是最高价,所以该离子具有强氧化性,能和强还原性的物质反应,氯气和氧气具有强氧化性,所以不能和高铁酸根离子反应,二氧化硫和硫化氢具有强还原性,所以能和高铁酸根离子反应,故选B、C.
