盐酸、硫酸和硝酸是中学阶段常见的“三大酸”,请就“三大酸”的性质,回答下列问题:
(1)稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解.该反应的化学方程式为______.
(2)某课外活动小组设计了以下实验方案验证Cu与浓硝酸反应的过程中可能产生NO.其实验流程图如下:
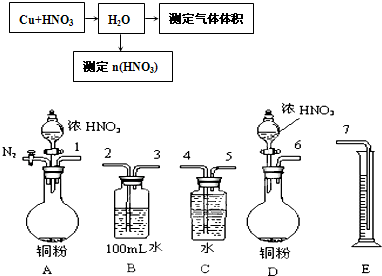
①若要测定NO的体积,从图所示的装置中,你认为应选用______装置进行Cu与浓硝酸反应实验,选用的理由是______.
②选用如图所示仪器组合一套可用来测定生成NO体积的装置,其合理的连接顺序是______(填各导管口编号).______
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置______(“下降”或“升高”),以保证量筒中的液面与集气瓶中的液面持平.
(3)工业制硫酸时,硫铁矿(FeS2)高温下空气氧化产生二氧化硫:4FeS2+11O2=8SO2+2Fe2O3,设空气中N2、O2的含量分别为0.800和0.200(体积分数),4.8t FeS2完全制成硫酸,需要空气的体积(标准状况)为______L.
(1)双氧水具有氧化性,在酸性环境下能将金属铜氧化,方程式为:Cu+H2O2+2HCl=CuCl2+2H2O;
故答案为:Cu+H2O2+2HCl═CuCl2+2H2O;
(2)①一氧化氮不溶于水,易被氧气氧化;实验方案验证Cu与浓硝酸反应的过程中可能产生NO,装置中不含氧气,选A装置,其中氮气不和一氧化氮反应,可以起到把装置中的空气赶净的作用,防止一氧化氮被氧气氧化;
故答案为:A,因为A装置可以通N2将装置中的空气排尽,防止NO被空气中O2氧化;
②组合一套可用来测定生成NO体积的装置,需要显通过水吸收挥发出的硝酸和生成的二氧化氮气体,然后用排水量气的方法测定生成的一氧化氮;依据装置导气管的连接顺序,洗气应长进短处,量气应短进长出,故答案为:123547;
③在测定NO的体积时,若量筒中水的液面比集气瓶的液面要低,此时应将量筒的位置升高,以保证量筒中的液面与集气瓶中的液面持平,保持内外大气压相同,故答案为:升高;
(3)工业制硫酸时,硫铁矿(FeS2)高温下空气氧化产生二氧化硫:4FeS2+11O2=8SO2+2Fe2O3,设空气中N2、O2的含量分别为0.800和0.200(体积分数),4.8t FeS2完全制成硫酸,设硫铁矿完全反应需要氧气物质的量为X;二氧化硫物质的量为Y;二氧化硫氧化为三氧化硫需要氧气物质的量为Z;
4FeS2+11O2=8SO2+2Fe2O3,
4×120 11 8
4.8×106g X Y
X=1.1×105mol
Y=8×104mol
2SO2+O2=2SO3
2 1
8×104 Z
Z=4×104mol
空气的体积=
L=1.68×107L(1.1×104+4×104)×22.4 0.2
故答案为:1.68×107
