硫酸铵是一种常用的铵态氮肥.下表是硫酸铵化肥品质的主要指标.
| 指标 项目 | 优等品 | 一等品 | 合格品 |
| 外观 | 白色结晶,无可见机械杂质 | 无可见机械杂质 | |
| 氮(N)含量 | ≥21.0% | ≥21.0% | ≥20.5% |
.
[观察外观]
该硫酸铵化肥无可见机械杂质.
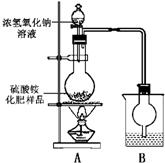
[实验探究]
按如图所示装置进行实验.
(1)烧瓶内发生反应的离子方程式为:______烧杯中盛放的试剂最好是______(填“浓硫酸”、“稀硫酸”或“水”)
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是______
[交流讨论]
甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:______
乙同学:实验装置中还存在另一个明显缺陷是:______
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验
[探究结论]
称取13.5g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4g.得出探究结论为______.
(1)硫酸铵和氢氧化钠反应生成硫酸钠、水和氨气,反应方程式为:(NH4)2SO4+2NaOH
Na2SO4+2NH3↑+2H2O,离子反应为NH4++OH- △ .
NH3↑+H2O,烧杯中盛放的试剂是用来吸收氨气的,所以用稀硫酸, △ .
故答案为:NH4++OH-
NH3↑+H2O;稀硫酸; △ .
(2)氢氧化钠的浓溶液,电离出的氢氧根离子浓度大,与铵根离子反应的氢氧根离子浓度大,加热温度高,反应速度快,所以,加入足量浓氢氧化钠溶液并充分加热,能使硫酸铵充分反应完全转化为NH3,
故答案为:使硫酸铵充分反应完全转化为NH3;
[交流讨论]制取氨气为氢氧化钠溶液与硫酸铵固体反应,所以生成的氨气中含有水蒸气,随氨气一同进入B装置中,影响氨气的质量,影响含氮量的测定,所以需增加一个干燥装置;反应装置中各部分都残留氨气,需将反应装置中残留的氨气赶出,
故答案为:A、B装置间缺一个干燥装置;缺少赶尽反应装置中残留氨气的装置;
[探究结论]
增重的3.4g为氨气的质最,设13.5g样品中含有(NH4)2SO4的质量为x:
(NH4)2SO4+2NaOH
Na2SO4+2NH3↑+2H2O △ .
132 34
x 3.4g
132:34=x:3.4g 解得:x=13.2g
=0.1mol,含0.2mol氮原子,氮的质量为2.8g,13.2g 132g/mol
×100%=20.7% 20.5%≤20.7%≤21.0%,为合格品,2.8g 13.5g
故答案为:该化肥为合格品;
