某课外活动小组做了如下关于钾的探究实验.
(1)钾与水反应
实验中钾常会着火燃烧,并发生轻微爆炸,由此现象可以得出的结论是______(任写一个),该反应的离子方程式是______.
(2)钾与氯气反应
该实验中可选用如下方案制备氯气,其中最合理的是______(填序号).
| 方案序号 | 所用试剂 | 净化剂 | 干燥剂 |
| A | MnO2、稀盐酸 | 饱和食盐水 | 浓硫酸 |
| B | Ca(ClO)2、浓盐酸 | 饱和食盐水 | 无水硫酸铜 |
| C | 氯酸钾、浓盐酸 | 饱和碳酸钠溶液 | 浓硫酸 |
| D | KMnO4、浓盐酸 | 水 | 碱石灰 |
A.长颈漏斗 B.圆底烧瓶
C.酒精灯 D.洗气瓶
(3)钾与氧气反应的实验
经查找资料知:钾与氧气反应可能生成K2O、K2O2、KO2.
①取一定量的钾在空气中点燃,使其充分反应;
②将生成物研成细粉备用;
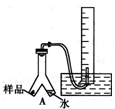
③常温下,利用如图所示装置探究生成物成分及含量.
据此回答下列问题:
①使细粉末与水反应的操作是______.
②测量气体体积时应注意的事项是______.
③若钾与氧气燃烧的产物为K2O2、KO2,取燃烧产物3.94g进行上述实验,测得气体的体积为868.0mL,则KO2的质量分数约为______.
(已知:常温下,气体的摩尔体积为24.8L/mo1)
(1)钾和水发生反应常会着火燃烧,并发生轻微爆炸,说明反应是放热反应,反应的离子方程式为:2K++2H2O=2K++2OH-+H2↑;
故答案为:钾与水反应放热,2K++2H2O=2K++2OH-+H2↑;
(2)A、MnO2、稀盐酸不能反应生成氯气,故A错误;
B、Ca(ClO)2具有强氧化性能氧化浓盐酸生成氯气,通过饱和食盐水除去氯化氢,通过无水硫酸铜吸收水蒸气,故B正确;
C、氯酸钾、浓盐酸反应生成氯气,通入饱和碳酸钠溶液吸收氯化氢反应生成二氧化碳,也吸收氯气反应,故C错误;
D、KMnO4具有强氧化性氧化浓盐酸生成氯气,水除去氯化氢,同时吸收氯气,碱石灰会吸收氯气,故D错误;
故选B.
制备氯气后的净化装置需要用洗气瓶进行,加入液体用分液漏斗,反应容器可以是试管、烧瓶等,反应有的需要加热反应,有的常温反应,故选D.
(3)①使细粉末与水反应的操作,将仪器A向左倾斜,使水与样品充分接触发生反应;
故答案为:将仪器A向左倾斜,使水与样品充分接触;
②依据实验装置,测量气体体积时应注意的事项是,将气体冷却到室温,移动量筒使量筒内外液面相平,使量筒内的气体压强与大气压相等,平视读数;
故答案为:将气体冷却到室温,移动量筒使量筒内外液面相平,使量筒内的气体压强与大气压相等,平视读数;
③设样品中K2O2为 xmol,KO2物质的量为ymol,依据化学方程式2K2O2+2H2O=4NaOH+O↑;4KO2+2H2O=4KOH+3O2↑;
得到110x+71y=3.94
+x 2
=3y 4 0.868 24.8
解得:x=0.01,y=0.04,
所以KO2的质量分数=
×100%=72.08%0.04×71 3.94
故答案为:72.08%
