根据下列实验现象,所得结论不正确的是( )
| 实验 | 装置 | 实验现象 | 结论 |
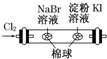
| A |
| 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
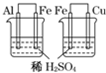
| B |
| 左边烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
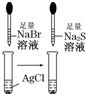
| C |
| 白色固体先变为淡黄色,后变为黑色(Ag2S) | 溶解性:AgCl>AgBr>Ag2S |
| D |
| 锥形瓶中有气体产生,烧杯中液体变浑浊 | 酸性:HCl>H2CO3>H2SiO3 |
A.A
B.B
C.C
D.D
A、氯气具有氧化性,能将溴离子氧化为溴单质,溴单质为橙色,同时次氯酸的漂白性将橙色漂白,氯气能将碘离子氧化为碘单质,碘单质遇到淀粉显示蓝色,同时次氯酸的漂白性将橙色漂白,所以氧化性是Cl2>Br2,Cl2>I2,现象是:左边棉花先变橙色再变无色,右边棉花先变蓝色后变无色,故A错误;
B、两个烧杯形成原电池的工作原理,左边烧杯中,金属铝是负极,右边烧杯中金属铁是负极,在原电池的正极上会产生氢气,负极活泼性强于正极,故B正确;
C、氯化银的溶解能力大于溴化银,溴化银的溶解能力大于碘化银,根据现象结合沉淀会向着更难溶的方向转化,所以溶解性:AgCl>AgBr>Ag2S,故C正确;
D、锥形瓶中有气体二氧化碳产生,烧杯中液体有浑浊硅酸产生,现说明盐酸酸性强于碳酸,碳酸酸性强于硅酸,故D正确.
故选A.