某校化学兴趣小组为探究铜的常见化合物性质,提出了如下问题进行探究.请你协助该小组的同学完成下列探究活动.
提出问题①CuO能否被NH3还原?②如何安全的进行“钠投入CuSO4 溶液反应”的实验?
资料卡片Cu2O是红色粉末.Cu+在酸性溶液中能发生自身氧化还原反应生成Cu2+和Cu.
实验方案(1)为解决问题①,设计的实验装置如下(夹持及尾气处理装置未画出):
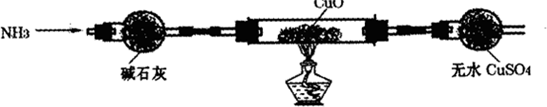
实验中观察到黑色CuO变为红色物质,无水CuSO4变蓝色,同时生成一种无污染的气体.
(2)为解决问题②,该小组做了以下两组实验:
I.分别取40mL2%的CuSO4 溶液三份,各加入质量不同的钠块,实验现象如下:
| 钠块质量 | 实验现象 |
| 0.2g | 钠块剧烈燃烧,发出爆炸声,少量的钠溅出 |
| 0.1g | 钠块燃烧,发出爆炸声 |
| 0.05g | 钠块四处游动,偶有轻微的爆炸声,未见钠块燃烧 |
实验结论
(1)CuO能被NH3还原,该反应的化学方程式为______.
(2)在40mL2%的CuSO4 溶液,加入约______g的钠块是安全的.
问题讨论
(1)有同学认为:NH3与CuO反应生成的红色物质可能含有Cu2O.你认为他的看法是否正确?______(填是或否),请你设计一个实验检验该红色物质中是否含有Cu2O.______.
(2)从“钠投入CuSO4 溶液反应”的实验结果来看,硫酸铜溶液的浓度越大,越容易发生爆炸.你认为可能的原因是什么?提出猜想,并设计实验检验你的猜想.猜想:______;检验方案______.
实验结论(1)黑色CuO变为红色物质说明生成物为Cu,无水CuSO4变蓝色说明生成水,同时生成一种无污染的气体,应为氮气,则反应的化学方程式为2NH3+3CuO
N2+3Cu+3H2O, △ .
故答案为:2NH3+3CuO
N2+3Cu+3H2O; △ .
(2)由加入Na的质量看出,当加入0.05gNa时,反应最为缓和,也最安全,故答案为:0.05;
问题讨论:(1)Cu2O也为红色固体,与稀硫酸反应,但铜和稀硫酸不反应,所以可取少量样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之,则没有,
故答案为:是;取少量样品,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有Cu2O,反之,则没有;
(2)可用以下几种猜想和检验方案:
猜想1:硫酸铜溶液浓度大,生成氢氧化铜絮状沉淀多,阻止了钠块的游动,使得热量积聚,从而引发爆炸.
检验方案:用不同浓度的硫酸铜溶液加入一定浓度NaOH溶液生成絮状氢氧化铜沉淀后,立即加入0.1g钠块实验,观察现象.
猜想2:硫酸铜溶液浓度越大,溶液酸性越强,反应越剧烈,放出热量来不及扩散,从而引发爆炸.
检验方案:取两份体积相同浓度均为1%的硫酸铜溶液,其中一份滴加几滴稀硫酸,然后各加入0.1g钠块进行实验,观察现象.
猜想3:溶液浓度越大,使得钠块越难移动,热量积聚,从而引发爆炸.
检验方案:用不同浓度的NaCl溶液,再加入0.1g钠块实验,观察现象.
故答案为:硫酸铜溶液浓度大,生成氢氧化铜絮状沉淀多,阻止了钠块的游动,使得热量积聚,从而引发爆炸;用不同浓度的硫酸铜溶液加入一定浓度NaOH溶液生成絮状氢氧化铜沉淀后,立即加入0.1g钠块实验,观察现象(或其它合理答案).
