工业上利用硫酸渣(含Fe2-、Fe3-的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如图:
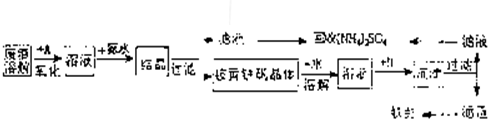
回答下列问题:
(1)在废渣溶解操作时,应选用______溶解(填编号).
A.硫酸 B.盐酸 C.氢氧化化钠 D.氨水
(2)物质A是一种氧化剂,工业上最好选用______(供选择使用的有:H2O2、空气、Cl2、MnO2等),其理由是______.
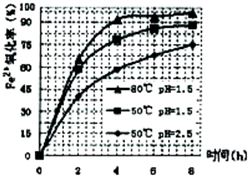
(3)根据下图有关数据,你认为工业上氧化操作时应采取的措施是______.
(4)往铵黄铁矾(化学式为:(NH4)2Fe6SO4)4(OH)12)溶液中加入溶液B至pH为5时产生沉淀,请写出产生沉淀的离子方程式:______.
(5)若对硫酸渣加强热也可粗制铁红,但产品纯度低而档次低,请写出硫酸渣中硫酸亚铁加强热制备铁红的化学方程式:

(1)在废渣溶解操作时,目的是溶解氧化物,制备高档颜料铁红(Fe2O3 )和回收(NH4)2SO4,不能引入杂质离子;
A、硫酸能溶解氧化钙和氧化镁,且不引入杂质离子,故A符合;
B、盐酸溶解氧化钙和氧化镁,但引入氯离子不能除去,故B不选;
C、氢氧化钠溶液沉淀铁离子和亚铁离子不能溶解氧化钙、氧化镁,故C不选;
D、氨水不能溶解氧化物,能沉淀铁离子和亚铁离子,故D不选;
故答案为:A;
(2)氧化剂主要是氧化亚铁离子便于提取,氯气有毒乙污染空气,二氧化锰是难溶于水的固体,空气来源丰富,成本低,不引入杂质,不产生污染,
故答案为:空气;原料来源容易,成本低,不产生污染,不引入杂质;
(3)分析图象可知在80°C时 溶液PH=1.5,此时亚铁离子的氧化率在90%以上,时间在4小时左右,
故答案为:溶液温度为80℃,pH为1.5,时间为4小时左右;
(4)往铵黄铁矾加入溶液B为氨水,至pH为5时产生沉淀,生成的是氢氧化铁沉淀反应离子方程式为:Fe3++3NH3•H2O=Fe(OH)2↓+3NH4+,
故答案为:Fe3++3NH3•H2O=Fe(OH)2↓+3NH4+;
(5)硫酸亚铁受热分解制的铁红为Fe2O3,依据氧化还原反应和电子守恒分析判断做氧化剂元素化合价降低的是硫元素化合价变化为+4价,依据原子守恒配平写出化学方程式为:2FeSO4=Fe2O3+SO2↑+SO3↑,故答案为:2FeSO4=Fe2O3+SO2↑+SO3↑.
