锗(Ge)是第ⅣA族元素,它的单质是一种良好的半导体材料,被广泛地应用在电子工业上,锗可以从烟道灰中提取,其过程如下:
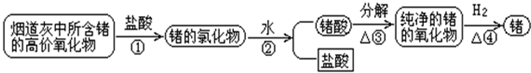
(1)写出上述各步反应的化学方程式①______;②______;③______;④______.
(2)提取过程中①至③的作用是什么?从节约资源角度考虑哪一步的产物可以循环使用?
(1)①锗最外层有4个电子,所以其最高价为+4,锗的最高价氧化物为GeO2,与HCl(aq)发生复分解反应,生成的氯化物应为GeCl4和H2O,反应方程式为:GeO2+4HCl═GeCl4+2H2O.
故答案为:GeO2+4HCl═GeCl4+2H2O.
②GeCl4水解反应:GeCl4+4H2O

Ge(OH)4+4HCl(正反应吸热),生成原锗酸H4GeO4与HCl,原锗酸H4GeO4失水变为锗酸H2GeO3,反应方程式为GeCl4+4H2O═H4GeO4+4HCl、H4GeO4═H2GeO3+H2O(或GeCl4+3H2O═H2GeO3+4HCl )
故答案为:GeCl4+4H2O═H4GeO4+4HCl、H4GeO4═H2GeO3+H2O(或GeCl4+3H2O═H2GeO3+4HCl ).
③GeCl4水解反应:GeCl4+4H2O

Ge(OH)4+4HCl(正反应吸热),生成原锗酸H4GeO4与HCl,加热平衡向右移动,HCl逸出,且水分不断蒸发,原锗酸H4GeO4失水变为锗酸H2GeO3,H4GeO4失水变为锗酸H2GeO3,锗酸受热分解为GeO2.
锗酸受热分解为GeO2与水,反应方程式为H2GeO3
GeO2+H2O. △ .
故答案为:H2GeO3
GeO2+H2O. △ .
④GeO2与H2发生氧化还原反应,H2夺去GeO2中的O生成H2O,Ge被还原出来.反应方程式为GeO2+2H2
Ge+2H2O. △ .
故答案为:GeO2+2H2
Ge+2H2O. △ .
(2)前三步的主要作用是分离、提纯和富集锗的氧化物.
第②步中产生的盐酸可以循环到第①步中使用,①③④中产生的水也可以循环到第②步使用.
故答案为:前三步的主要作用是分离、提纯和富集锗的氧化物.
第②步中产生的盐酸可以循环到第①步中使用,①③④中产生的水也可以循环到第②步使用.
