下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:

(1)④⑤⑥的原子半径由小到大的顺序为(用元素符号表示) ;
②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示) 。
(2)写出由以上某些元素构成的既含离子键、又含极性共价键的化合物的电子式(写出一种即可) 。
(3)已知常温下1 g①单质在④单质中燃烧生成稳定的液态物质时放出142.9 kJ热量,则表示①单质燃烧的热化学方程式为 。
(4)①②形成的最简单的化合物与④单质在KOH作电解质溶液时可形成原电池,其中负极的电极反应为 。
(5)由表中元素①③④⑥⑧所形成的常见物质X、Y、Z、M、N可发生以下反应:
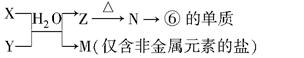
①X溶液与Y溶液反应的离子方程式为 ;
②N→⑥的单质所采用的方法是 ;
③M溶液呈酸性,原因是(用离子方程式解释) 。
(1)O<Al<Na;H2SiO3<H2CO3<HNO3
(2) 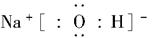 (答案合理即可)(3)H2(g)+1/2O2(g)=H2O(l)ΔH=-285.8 kJ·mol-1
(答案合理即可)(3)H2(g)+1/2O2(g)=H2O(l)ΔH=-285.8 kJ·mol-1
(4)CH4-8e-+10OH-=CO32-+7H2O
(5)①Al3++3NH3·H2O=Al(OH)3↓+3NH4+
②电解法 ③NH4++H2O NH3·H2O+H+
NH3·H2O+H+
(1)④⑤⑥分别为O、Na和Al,电子层数越多,则半径越大。若位于同一周期,则核电荷数大的半径反而小。同主族,最高价氧化物对应水化物的酸性,从上至下减弱。同周期,酸性从左至右增强。(2)离子键应存在于活泼金属元素与非金属元素(NH4Cl除外)之间,极性共价键存在于不同种非金属元素之间。(4)CH4与O2反应生成CO2,CO2与KOH继续反应生成CO32-,所以负极反应的产物为CO32-。(5)M为仅含非金属元素的盐,则应为铵盐,⑥为Al元素,由图分析可知,X与Y反应,应为Al3+与氨水的反应。Al为活泼金属,故应采用电解法获得。铵盐溶液呈酸性是因为NH4+水解。
