聚合氯化铝晶体的化学式为[Al2(OH)nCl6-n•XH2O]m,它是一种高效无机水处理剂,它的制备原理是调节增大AlCl3溶液的pH,通过促进其水解而结晶析出.其制备原料主要是铝加工行业的废渣--铝灰,它主要含Al2O3、Al,还有SiO2等杂质.聚合氯化铝生产的工艺流程如下:
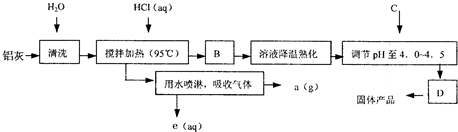
(1)搅拌加热操作过程中发生反应的离子方程式为:______;______.
(2)生产过程中B和D的操作名称分别是______和______(B和D均为简单操作).
(3)反应中副产品a是______.
(4)生产过程中可循环使用的物质是______(用化学式表示).
(5)调节pH至4.0~4.5的目的是______.
(6)实验室要测定水处理剂产品中n和x的值.为使测定结果更准确,需得到的晶体较纯净.生产过程C物质可选用______.
A.NaOH B.Al C.氨水 D.Al2O3 E.NaAlO2.
(1)氧化铝与盐酸反应生成氯化铝和水,反应离子方程式为Al2O3+6H+=2Al3++3H2O;
铝与盐酸反应生成氯化铝与氢气,反应离子方程式为2Al+6H+=2Al3++3H2↑.
故答案为:Al2O3+6H+=2Al3++3H2O;2Al+6H+=2Al3++3H2↑;
(2)铝灰与过量的盐酸反应,过滤后收集滤液,加热浓缩至饱和,调pH值,稍静置,过滤收集滤渣,最终的这个滤渣就是我们要的晶体,所以生产过程中操作B和D的均为过滤.
故答案为:过滤、过滤;
(3)搅拌加热操作过程,加入盐酸,铝与盐酸反应,有氢气生成,加热的时候HCl会挥发,用水喷淋就可以吸收HCl,得到HCl(aq),剩余气体为氢气,反应中副产品a为H2.
故答案为:H2.
(4)95°C加热的时候HCl会挥发,用水喷淋就可以吸收HCl,得到HCl(aq),可进行循环使用.
故答案为:HCl;
(5)铝离子水解,Al3++3H2O⇌Al(OH)3+3H+,降低氢离子浓度促进铝离子水解,有利于聚合氯化铝晶体析出.
故答案为:促进AlCl3水解,使晶体析出;
(6)用氢氧化钠和氨水调节pH值,会引入新的杂质,引入钠离子和铵根离子.所以可以加入Al和氧化铝进行处理,它二者是固体,多了可以过滤掉的,所以可以使得到的晶体较纯净.
故答案为:BD.
