下图是甲、乙、丙三名同学设计的验证铜和浓硝酸反应原理的装置
已知:2NO2+2NaOH═NaNO3+NaNO2+H2O
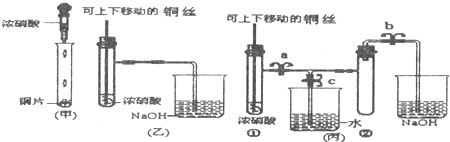
(1)写出铜和浓硝酸反应的离子反应方程式是______.
(2)和甲同学装置相比,乙同学设计的装置的优点是______、______.
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置.
先关闭弹簧夹______(填a或b或c),再打开弹簧夹______和______(填a或b或c),才能使NO2气体充满②试管.
(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管.应如何操作______.
(5)某位同学的实验中未得到蓝色的溶液,而呈绿色,他分析可能是生成的部分NO2溶解在溶液中造成的.请你帮他设计简单实验方案验证他的推测.
(1)因铜和浓硝酸反应生成硝酸铜、二氧化氮和水,故答案为:Cu+4H++2NO3_=Cu2++2NO2↑+2H2O;
(2)甲装置不能使反应可控制;不能吸收NO2气体,污染环境,
故答案为:①不能使反应可控制②不能吸收NO2气体,污染环境
(3)为了NO2气体充满②试管,应先关闭c,然后打开a、b,故答案:关闭c;a、b;
(4)为了让二氧化氮与水接触发生反,应先关闭b,再关闭a,然后打开c,用手捂住(热水、热毛巾、加热)试管②,
故答案为:先关闭b,再关闭a,然后打开c,用手捂住(热水、热毛巾、加热)试管②;
(5)铜和稀硝酸反应生成一氧化氮和硝酸铜溶液呈蓝色,铜和浓硝酸反应生成硝酸铜、二氧化氮和水,二氧化氮是红棕色气体,溶解于溶液中溶液可能成绿色;
故答案为:用Cu和稀HNO3反应,若所得溶液呈蓝色,则证明Cu和浓HNO3反应呈绿色的原因是NO2溶解在溶液中造成的;
