铝是国民经济发展的重要材料,铝在地壳中的含量约占8%,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁.请回答下问题:
(I )实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:Al
Al3+H2SO4
Al(OH)3;NaOH
方案2:AlNaOH AlO -2
Al(OH)3;H2SO4
方案3:
→Al(OH)3;Al
Al2(SO4)3H2SO4 Al
NaAlO2NaOH
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案______.
(II)工业上冶炼铝的流程图如图所示:
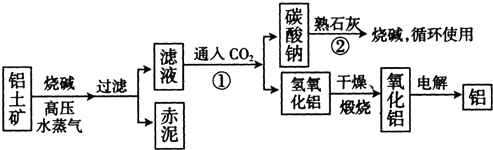
在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe203质量分数的数据如下:
| Al2O3 | Fe2O3 | 其他杂质 | |
| 铝土矿 | 55% | 16% | - |
| 赤泥 | 15% | 48% | 一 |
(2)电解氧化铝生产铝时,阳极的电极反应式为______.
(3)假设其它杂质不参加反应,则每生产3.4t纯净的氧化铝,需铝土矿______t.
(Ⅰ)根据金属铝和酸以及和碱发生反应的化学方程式可以得出:Al~3H+~Al3+~Al(OH)3,
Al~OH-~[Al(OH)4]-,Al3++3[Al(OH)4]-=4Al(OH)3↓,所以制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案3,故答案为:3;
(Ⅱ)(1)向偏铝酸钠中通入二氧化碳反应会生成氢氧化铝沉淀,即2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓,碳酸钠可以和氢氧化钙发生复分解反应Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,
故答案为:2NaAlO2+CO2+3H2O=Na2CO3+2Al(OH)3↓;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(2)电解池中,阳极是惰性电极时,该极上是阴离子O2-发生失电子的氧化反应:2O2--4e-=O2↑,
故答案为:2O2--4e-=O2↑;
(3)根据铝土矿中氧化铝的质量分数为55%,所以每生产3.4t纯净的氧化铝,需铝土矿的质量:
=6.18(t),3.4 55%
故答案为:6.18.
