碳酸钙常用作牙膏的摩擦剂.某同学设计了一种制备碳酸钙的方案,其流程图如下.(所用石灰石含有杂质SiO2)

回答下列问题:
(1)充分煅烧110吨石灰石得到固体66吨.标准状况下生成二氧化碳的体积为______L,石灰石中碳酸钙的质量分数为______%.
(2)假设第①步反应完全进行,则第②步反应过滤后得到的不溶液性滤渣的成分为______.
(3)第③步反应一般不采用通入CO2的主要原因是______,相应的离子方程式为______.
(4)CaCO3是一种难溶液物质,25℃时其KSP=2.8×10-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2.0×10-4mol/L,则生成沉淀所需CaCl2溶液的物质的量浓度最小是______.
(5)某生用石灰石为原料,设计了另一种制备碳酸钙的实验方案,其流程图如下
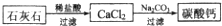
与前一方案相比较,该方案的优点是______.
(1)根据碳酸钙分CaCO3
CaO+CO2↑△m 高温 .
100 56 44 44
100×106g 44×106 g 44×106g
所以生成二氧化碳的体积为
mol×22.4L/mol=2.24×107 L,44×106 44
石灰石中碳酸钙的质量分数为
× 100%=90.9%100×106 110×106
故答案为:2.24×107 90.9
(2)碳酸钙除了分解,还与SiO2发生反应:SiO2+CaCO3 =CaSiO3+CO2SiO2+CaCO3
CaSiO3+CO2↑,所以SiO2+CaCO3 =CaSiO3+CO2不溶液性滤渣的成分 高温 .
CaSiO3,故答案为:CaSiO3;
SiO2+CaCO3 =CaSiO3+CO2
(3)因CO2过量时,会继续与碳酸钙反应,
故答案为:通入CO2的量不易控制,使生成的碳酸钙在CO2过量的条件下溶解;CaCO3+CO2+H2O═Ca2++2HCO3-
(4)因QC≥KSP时,形成沉淀,C(Ca2+)≥
mol•L-1=2.8×10-5mol•L-1,等体积混合前CaCl2溶液的物质的量浓度最小为5.6×10-5 mol•L-1,故答案为:5.6×10-5 mol•L-12.8×10-9 1×10-4
(5)因与前一方案相比较,可知制备过程不需要加热、操作简便等,故答案为:不需要加热,操作简便,减少来自燃料的污染
