工业合成氨与制备硝酸一般可连续生产,流程如下:
(1)在合成氨的反应中,改变反应条件,会使平衡发生移动.如图象表示随条件改变,氨气的百分含量的变化趋势.
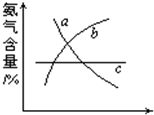
当横坐标为压强时,变化趋势正确的是(选填字母序号)______,
当横坐标为温度时,变化趋势正确的是(选填字母序号)______.
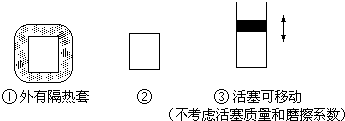
(2)如图所示三个容积相同的容器①、②、③,若起始温度相同,分别向三个容器中充入3mol H2和1mol N2,一定条件下反应,达到平衡时各容器中NH3物质的百分含量由大到小的顺序为______(填容器编号)
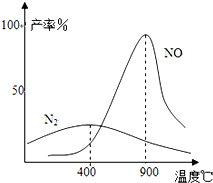
(3)氨气和氧气从145℃就开始反应,在不同温度和催化剂条件下生成不同产物(如图所示):
4NH3+5O2

4NO+6H2O
4NH3+3O2

2N2+6H2O
温度较低时以生成______为主,温度高于900℃时,NO产率下降的原因______.吸收塔中需要补充空气的原因______.
(1)、工业合成氨为N2+3H2
2NH3 △H<0 增大压强时平衡向右进行,氨气的百分含量增大,催化剂 . 高温高压
因△H<0,为放热反应,增加温度,平衡向逆反应方向移动,氨气的百分含量减少,故答案为:b,a.
(2)、以②为基准,①外有隔热套,相当于在②基础上加热平衡向逆反应方向移动,氨气的百分含量减少.③是恒压状态,相当于在②基础上加压,平衡向右进行,氨气的百分含量增大.所以NH3物质的百分含量由大到小的顺序为①<②<③
故答案为:①<②<③;
(3)、由图象可知在温度较低时生成氮气.温度高于900℃时,NO产率下降是因为反应4NH3+5O2

4NO+6H2O时放热反应,达到平衡后,升温平衡逆向进行.故产率降低.吸收塔中需要补充空气是增加反应物的浓度,使平衡向正向移动,进一步与NO反应生成硝酸.
故答案为:N2;生成NO的反应为放热反应,升高温度转化率下降;进一步与NO反应生成硝酸.
