将氯气用导管通入较浓的NaOH和H2O2的混和液中,在导管口与混和液的接触处有闪烁的红光出现.这是因为通气后混和液中产生的ClO-被H2O2还原,发生激烈反应,产生能量较高的氧分子,它立即转变为普通氧分子,将多余的能量以红光放出.
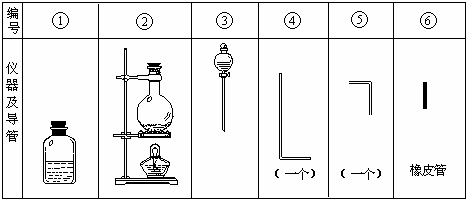
进行此实验,所用的仪器及导管如图.
根据要求填写下列空白:
(1)组装氯气发生器时,应选用的仪器及导管(填写图中编号)是______.
(2)实验进行中,按气流方向从左到右的顺序,气体流经的各仪器及导管的编号依次是______.
(3)仪器①的橡皮塞上应有______个孔,原因是______.
(4)实验时,仪器①中除观察到红光外还有______现象.
(5)实验需用约10%H2O2溶液100毫升,现用市售30%(密度近似为1克/厘米3)H2O2来配制,其具体配制方法是______.
(6)实验时仪器①中ClO-与H2O2反应的离子方程式是______.
(1)由于反应物是二氧化锰和浓盐酸,所以在反应前二者不能混合,用分液漏斗来装浓盐酸,需要第③装置,反应条件是加热,需要第②个装置,还需要用导管导出氯气,所以用到⑤;
故答案为:③②⑤;
(2)第④中的长导管是将产生的氯气导入第①个装置的,所以需要用橡皮管将长导管与短导管连接起来,所以气体流经的各仪器及导管的编号依次是②⑤⑥④①;
故答案为:②⑤⑥④①;
(3)由于瓶内产生氧气,会使瓶内压强增大,容易将橡皮塞鼓开或发生爆炸,用小孔是为了使瓶内外压强相等;
故答案为:使瓶内外压强相等;
(4)因为有氧气产生所以会产生气泡,故答案为:冒气泡;
(5)溶液稀释溶质不变列等式:x×30%=100毫升×1g/cm3×10% 解得x=33g,
=33mL,再加入水:67毫升33g 1g/mL
故答案为:用量筒量取33毫升30%(密度近似为1g/cm3)H2O2溶液加入烧杯中,再加入67毫升水,搅拌均匀;
(6)次氯酸根离子有强氧化性,双氧水有还原性,所以次氯酸根离子和双氧水发生氧化还原反应生成氯离子、氧气和水,所以离子方程式为ClO-+H2O2=Cl-+O2↑+H2O,故答案为:ClO-+H2O2=Cl-+O2↑+H2O.
