某同学设计了图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请回答:
(1)若A为浓氨水,B为烧碱,C为AlCl3溶液,打开分液漏斗旋塞,烧瓶中即有氨气生成,
原因是______(结合离子方程式回答).一段时间后,观察到试管中的现象是______,
发生反应的离子方程是______.
(2)利用该装置设计实验证明醋酸、碳酸、苯酚的酸性强弱,若B为碳酸钠,A与B发生反应的离子方程式是______,能得到的相应结论是______;试管中出现浑浊,依据此现象能否得出相应的结论,请简述理由:______.
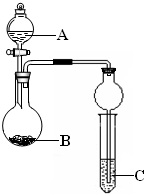
(1)NaOH(固体)溶于放热,温度升高,氨气的溶解度变小,氨气溢出,NaOH溶于水,增大OH-的浓度,氨气溶于水是可逆的,NH3+H2O⇌NH3•H2O⇌NH4++OH-,氨气溶解度变小,氨气溢出,促使化学平衡逆向移动;氨气从图中左边装置逸到右边装置中,C为AlCl3溶液电离出铝离子和氯离子,NH3+H2O⇌NH3•H2O⇌NH4++OH-,铝离子和氢氧根离子反应,生成氢氧化铝白色沉淀,
故答案为:在氨水中有下列平衡:NH3+H2O⇌NH3•H2O⇌NH4++OH-,NaOH固体溶于水放热,使得氨气的溶解度减小,同时增大了溶液中的c(OH-),促使化学平衡逆向移动;有白色沉淀产生;Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(2)醋酸和碳酸都是弱酸,但相同浓度的醋酸和碳酸,醋酸的电离程度比碳酸强,所以醋酸的酸性比碳酸强,根据强酸制弱酸的特点,所以醋酸能和碳酸钠反应生成碳酸,若B为碳酸钠,A为醋酸,醋酸能和碳酸钠反应生成碳酸,但碳酸不稳定能分解生成水和二氧化碳,方程式为CO32-+2CH3COOH→2CH3COO-+H2O+CO2↑,试管中出现浑浊,看到澄清的苯酚钠溶液变浑浊,原因是苯酚钠和水、二氧化碳反应生成苯酚和碳酸氢钠,醋酸具有挥发性,也可能是苯酚钠和乙酸反应生成苯酚,所以不能判断,
故答案为:CO32-+2CH3COOH→2CH3COO-+H2O+CO2↑;醋酸酸性强于碳酸;不能,因为醋酸具有挥发性,挥发出的醋酸也可以和苯酚钠溶液发生反应,生成苯酚;
