工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
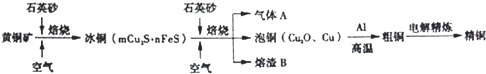
(1)气体A中的大气污染物可选用下列试剂中的______吸收.
A.浓H2SO4 B. 氨水 C.NaOH溶液 D.稀HNO3
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,检验溶液中还存在Fe2+的方法是______(注明试剂、现象).
(3)由泡铜冶炼粗铜的化学反应方程式为______.
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是______.
a.粗铜接电源正极,发生氧化反应 b.溶液中Cu2+向阳极移动
c.利用阳极泥可回收Ag、Pt、Au等金属 d.电能全部转化为化学能
(5)利用反应2Cu+H2O2+H2SO4═CuSO4+2H2O可制得CuSO4,若将该反应设计为原电池,其正极电极反应式为______.
(1)由流程图转化可知,气体A中的大气污染物主要是二氧化硫,选择试剂吸收二氧化硫,不能产生新的污染气体,
a、浓H2SO4不能吸收二氧化硫,故a错误;
b、氨水与二氧化硫反应生成亚硫酸铵,故b正确;
c、NaOH溶液与二氧化硫反应生成亚硫酸钠,故c正确;
d、稀HNO3可以吸收二氧化硫,但生成NO污染大气,故d错误;
故答案为:bc;
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明含有Fe3+;Fe2+具有还原性,可以利用KMnO4溶液检验,取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去,
故答案为:取少量溶液,滴加KMnO4溶液,KMnO4溶液紫色褪去;
(3)由流程图转化可知,Cu2O与Al反应置换反应生成Al2O3与Cu,反应方程式为3Cu2O+2Al
Al2O3+6Cu, 高温 .
故答案为:3Cu2O+2Al
Al2O3+6Cu; 高温 .
(4)a.精炼铜时,粗铜做阳极,连接电源正极,发生氧化反应故a正确;
b.溶液中Cu2+向阴极移动,故b错误;
c.Ag、Pt、Au不如铜活泼,铜放电后Ag、Pt、Au从粗铜脱落,利用阳极泥可回收Ag、Pt、Au等金属,故c正确;
d.反应中有热能产生,所以电能不是全部转化为化学能,故d错误;
故答案为:ac;
(5)利用反应2Cu+H2O2+H2SO4═CuSO4+2H2O可制得CuSO4,若将该反应设计为原电池,正极上是过氧化氢得到电子发生还原反应,酸性溶液中以水的形式存在,其正极电极反应式为:2H++H2O2+2e-=2H2O,故答案为:2H++H2O2+2e-=2H2O.
