下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
①一般认为H2SO4浓度大于60%,就具有一定的强氧化性,越浓氧化性越强,60%以下的H2SO4主要体现的是酸性,基本上不体现强氧化性.
②温度也影响氧化性,如铜放于冷的浓H2SO4中反应不明显,如果加热就可以观察到明显现象.
③98%的浓H2SO4物质的量浓度为18.4mol/L,密度为1.84g•cm-3,根据以上信息回答:
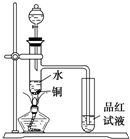
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3mL水,然后从分液漏斗中加98%的浓H2SO4 0.5mL,加热至沸腾,该试管中液体没有明显变化,试用数据解释原因______
(2)乙同学利用所示装置直接从分液漏斗中再加浓H2SO4 10mL与铜片反应.观察到右边试管中溶液褪色,这是因为______;若把品红试液换成硝酸酸化的硝酸钡溶液,产生的现象是______;
在左边试管中观察到的现象除了铜粉变黑色外,还有:①______,原因是______
②有白色固体在试管底部析出,原因是______;
(3)丙同学等乙同学实验结束后,取左试管(内有没反应完的铜)倾出上层清液于试管中来检验剩余的硫酸,他可以选择下列哪些试剂______(填写编号).
A.锌粉 B.银粉 C.氯化钡溶液 D.碳酸氢钠溶液.
(1)98%的浓H2SO4 0.5mL与3mL水混合后溶液的质量分数为
×100%=23%,小于60%,与铜不反应,0.5mL×1.84g/ml×98% 0.5mL×1.84g/mL+3g
故答案为:H2SO4溶液的质量分数为23%<60%,其氧化性不强,所以无明显现象;
(2)浓硫酸与铜在加热条件下发生氧化还原反应生成具有漂白性的二氧化硫和硫酸铜,二氧化硫可使品红褪色,二氧化硫具有还原性,可与硝酸发生氧化还原反应生成硫酸,若把品红试液换成硝酸酸化的硝酸钡溶液,可观察到由白色沉淀生成,反应后溶液呈蓝色,原因是溶液中含有铜离子,有白色固体在试管底部析出,原因是98%浓H2SO4有吸水性,生成无水CuSO4,
故答案为:生成具有漂白性的二氧化硫;由白色沉淀生成;液体呈浅蓝色;溶液中含有Cu2+;98%浓H2SO4有吸水性,生成无水CuSO4;
(3)检验硫酸,可用活泼金属或碳酸氢钠,都有气体生成,但不能用银,因银与稀硫酸不反应,无论是否有硫酸剩余,加入氯化钡,都有沉淀生成,故答案为:AD.
