A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,
B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
试回答:
(1)E元素在周期表中的位置为 ,写出E的最高价氧化物与D的最高价氧化物的水化物反应的离子方程式 。
(2) 由A、B、W三种元素组成的18电子微粒的结构简式为 。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式 。常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式 。
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式 。
(5) 元素D的单质在一定条件下,能与A单质化合生成一种氢化物DA,熔点为800℃。DA能与水反应放氢气,若将1mol DA和1 mol E单质混合加入足量的水,充分反应后生成气体的体积是 L(标准状况下)。
(1)第三周期,Ⅲ A族;Al2O3+2OH-="2" AlO2-+H2O
(2)CH3OH(写出分子式给1分)
(3)H2O2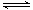 H++HO2—;BaO2+ H2SO4 = BaSO4↓+H2O2;
H++HO2—;BaO2+ H2SO4 = BaSO4↓+H2O2;
(4)Cu + 2H++ H2O2 = Cu2++ 2H2O
(5)56 L
题目分析: A、W能形成两种液态化合物A2W和A2W2,判断A、W分别为H、O元素,形成的化合物是水、过氧化氢。A、D同主族,D为Na元素。又因为原子序数逐渐增大,所以E为第三周期第三主族元素Al,五种元素的质子数之和为39,所以B为C元素。
(1)E为第三周期第三主族;D的最高价氧化物的水化物是氢氧化钠,则铝与氢氧化钠溶液反应的离子方程式为Al2O3+2OH-="2" AlO2-+H2O
(2)由H、C、O组成的18电子的物质是甲醇,结构简式为CH3OH;
(3)过氧化氢的电离是部分电离,H2O2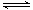 H++HO2-;硫酸与BaO2反应生成过氧化氢和硫酸钡,化学方程式为BaO2+ H2SO4 = BaSO4↓+H2O2;
H++HO2-;硫酸与BaO2反应生成过氧化氢和硫酸钡,化学方程式为BaO2+ H2SO4 = BaSO4↓+H2O2;
(4)铜与硫酸、过氧化氢反应,生成铜离子、水,其离子方程式为Cu + 2H++ H2O2 = Cu2++ 2H2O
(5)氢化物DA即NaH,与水反应产生氢氧化钠和氢气,所以1molNaH和1molAl与足量的水反应共生成2.5mol的氢气,标准状况下的体积为56L。
