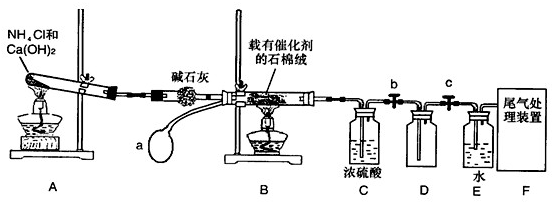
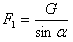某化学课外小组模拟工业生产制取HNO3,设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球.
请回答下列问题:
(1)写出装置A中主要反应的化学方程式______.
(2)检查装置A的气密性:先将A中导管下端浸入水中,再______.
(3)已知1molNO2与液态水反应生成HNO3溶液和NO气体放出热量45.5kJ,写出该反应的热化学方程式______,该反应是一个可逆反应,欲要提高NO2的转化率,可采取的措施是______
A.升高温度 B.降低温度 C.增大压强 D.减小压强
(4)实验结束后,关闭止水夹b、c,将装置D浸入冰水中,现象是______.
(5)装置C中浓H2SO4的作用是______.
(6)请你帮助该化学小组设计实验室制取NH3的另一方案______(用化学反应方程式表示).
(1)装置为实验室制氨气的实验装置,目的是制取氨气,所以化学方程式为:2NH4Cl+Ca(OH)2
2NH3↑+CaCl2+2H2O;故答案为:2NH4Cl+Ca(OH)2 △ .
2NH3↑+CaCl2+2H2O; △ .
(2)气密性检查是:将A中导管下端浸入水中,用双手紧握大试管底部,导管口有气泡产生,双手离开,导管产生一段水拄,说明装置A不漏气;
故答案为:用双手紧握大试管底部,导管口有气泡产生,双手离开,导管产生一段水拄,说明装置A不漏气;
(3)1molNO2与液态水反应生成HNO3溶液和NO气体放出热量45.5kJ,热化学方程式为3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-136.5kJ•mol-1,两种反应物,需加入一种物质的量来提高另一种物质的转化率,改变温度会改变平衡,对有气体参加的反应,改变压器平衡移动; 采取的措施:因反应是放热反应,所以降低温度平衡右移,二氧化氮转化率提高;反应前后气体体积减少,所以增大压强平衡右移,二氧化氮转化率提高;所以选BC;
故答案为:3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-136.5kJ•mol-1;BC;
(4)制得的二氧化氮气体会转化为四氧化二氮,形成化学平衡 2NO2⇌N2O4,正向是放热反应,二氧化氮气体是红棕色,四氧化二氮是无色气体,所以放入冰中温度降低,平衡右移,混合气体颜色变浅;故答案为:颜色变浅;
(5)浓硫酸具有吸水性,可以干燥与之不反应的气体,同时吸收过量的氨气;故答案为:干燥气体,吸收多余的NH3;
(6)利用浓氨水分解制取氨气,或把浓氨水滴入固体氢氧化钠,发生反应为NH3•H2O
NH3↑+H2O; △ .
故答案为:NH3•H2O
NH3↑+H2O; △ .