某课外活动小组为探究CO2与过量的NaOH溶液确实发生了化学反应,甲、乙、丙三位同学设计了下 * * 种实验装置,请回答下列问题:
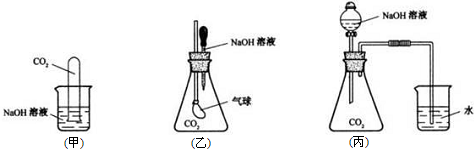
(1)甲装置中CO2与过量的NaOH反应的离子方程式______.
(2)丙装置实验现象是______,解释产生该实验现象的原因______.
(3)甲、乙、丙同学设计的三个方案中,有一个方案在实际操作中安全性存在问题,该方案是______ (填甲、乙或丙),原因是______.
(4)请设计一个实验检验生成的产物Na2CO3中的阴离子.(简述操作步骤、所用试剂、实验现象和结论.)
(5)实验室中若需用44.8L(标准状态)CO2,现用含CaCO390%石灰石与足量的盐酸反应,至少需要这种石灰石______g(结果保留一位小数).
(1)甲装置中CO2与过量的NaOH反应生成碳酸钠和水,反应的离子方程式为:CO2+2OH-=CO32-+H2O;
故答案为:CO2+2OH-=CO32-+H2O;
(2)丙装置中滴入氢氧化钠溶液和二氧化碳气体反应,丙内压强减小,烧杯中水会倒吸到锥形瓶,
故答案:当NaOH溶液滴入锥形瓶之后,烧杯中的水倒吸入锥形瓶;NaOH与CO2反应,导致锥形瓶内压强降低,在大气压的作用下,烧杯中的水倒吸入锥形瓶;
(3)甲、乙、丙同学设计的三个方案中,乙方案在实际操作中安全性存在问题,因为氢氧化钠滴入和二氧化碳反应后压强减小,气球会膨胀,有可能爆炸,
故答案为:乙;NaOH与CO2反应,锥形瓶内压强降低,在大气压的作用下,气球胀大,可能会发生爆炸;
(4)碳酸钠可以利用加入盐酸生成额一氧化碳气体的现象分析,操作步骤为:取少量生成物的溶液于试管,加入盐酸,生成无色无味的气体,则溶液中含有CO32-;
故答案为:取少量生成物的溶液于试管,加入盐酸,生成无色无味的气体,则溶液中含有CO32-;
(5)实验室中若需用44.8L(标准状态)CO2,物质的量为2mol,依据碳元素守恒得到,碳酸钙物质的量为2mol,质量为200g;现用含CaCO390%石灰石与足量的盐酸反应,至少需要这种石灰石质量=
=222.2g;200g 90%
故答案为:222.2;
