乙酰乙酸乙酯(CH3COCH2COOC2H5)是一种不溶于水的液体,熔点:-45°C,沸点:180.8℃,它是有机合成中常用的原料.在实验室,它可以由乙酸乙酯在乙醇钠的催化作用下缩合而制得,反应式为:
2CH3COOC2H5
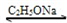
CH3COCH2COOC2H5+C2H5OH
反应中催化剂乙醇钠是由金属钠和残留在乙酸乙酯中的微量乙醇作用生成的,而一旦反应开始,生成的乙醇又会继续和钠反应生成乙酸钠.乙酰乙酸乙酯制备的流程如下:
金属钠,有机液体
钠熔化回流
小米状钠珠振荡② 回收有机液体③
橘红色溶液加入乙酸乙酯④
含乙酰乙酸乙酯的混合物乙酸酸化⑤ ⑥
乙酰乙酸乙酯粗产品⑦
阅读下面关于乙酰乙酸乙酯制备的实验过程,并回答有关问题.
(1)将适量干净的金属钠放入烧瓶中,为了得到小米状的钠珠,需将钠熔化,为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,下表是钠和一些常用有机液体的物理性质:
| 钠 | 苯 | 甲苯 | 对二甲苯 | 四氯化碳 | |
| 密度(g/cm3) | 0.97 | 0.88 | 0.87 | 0.86 | 1.60 |
| 熔点(℃) | 97.8 | 5.5 | -95 | 13.3 | -22.8 |
| 沸点(℃) | 881.4 | 80 | 111 | 138.4 | 76.8 |
理由是______.
(2)将烧瓶中的有机液体小心倾出,迅速加入适量乙酸乙酯,装上带有一根长玻璃导管的单孔胶塞,并在导管上端接一个干燥管.缓缓加热,保持瓶中混合液微沸状态.在实验中,使用烧瓶必须干燥,原料乙酸乙酯必须无水,原因是______,
烧瓶配上长导管的作用是______,导管上端接一干燥管的目的是______.
(3)步骤⑥为向混合溶液中加入饱和食盐水,其目的是______,写出步骤⑦实验操作的主要仪器______(填最主要一种).
粗产品(含乙酸乙酯和少量水及乙酸等)经过几步操作,最后成为纯品.
粗产品无水硫酸钠 过滤 水浴蒸馏
乙酰乙酸乙酯减压蒸馏
(4)向分离出的乙酰乙酸乙酯粗产品中加无水硫酸钠固体的作用是______.
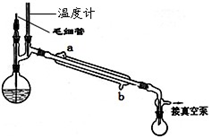
(5)精馏乙酰乙酸乙酯时需要减压蒸馏,装置如图所示.
冷凝管的进出水方向应______口进,______口出.毛细管的作用是______.
(6)实验最后所得产品远少于完全转化的理论产值,除了反应过程中的损耗外,主要原因是______.
(1)为了防止钠的氧化,熔化时需在钠上覆盖一层有机液体,则有机物的密度应比Na的小,并且沸点比Na的熔点高才符合,由于苯的沸点和钠的熔点相差较小,应用对二甲苯,
故答案为:对二甲苯;否;四氯化碳的沸点比钠的熔点低;
(2)因钠易与水反应,生成NaOH,使乙酸乙酯水解,则原料乙酸乙酯必须无水,烧瓶配上长导管可起到与空气充分热交换的作用,使蒸汽充分冷凝,实验必须在无水的环境中进行,可在导管上端接一干燥管,
故答案为:有水则钠和水反应生成NaOH,使乙酸乙酯水解;导气及冷凝回流;防止空气中的水蒸气进入烧瓶;
(3)乙酰乙酸乙酯难溶于饱和食盐水,可使生成的有机物分层,可用分液漏斗分离;
故答案为:使乙酰乙酸乙酯分层析出(分层);分液漏斗;
(4)无水硫酸钠固体具有吸水的作用,故答案为:干燥水分;
(5)蒸馏时,应从冷凝管的下口进水,上口出水,可使冷水充满冷凝管,起到充分冷凝的作用,毛细管的起到平衡压强、提供汽化中心、防暴沸的作用,
故答案为:b,a;平衡压强、提供汽化中心、防暴沸;
(6)该反应为可逆反应,反应物不可能完全转化,故答案为:反应是可逆反应,只能部分转化.
