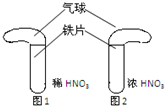
为研究硝酸的性质,小芳设计并完成如下性质:室温下,将等质量的铁片分别与足量的浓HNO3和稀HNO3反应(如图).回答下列问题:
(1)图1中发生反应的化学方程式是______.
该反应的氧化剂是______,图中气球的作用是______.
(2)为使图1所示的反应速率减慢,可采取的措施是______.
(3)图2所示实验无明显现象,小芳进一步探究如下:
假设①:常温下铁与浓硝酸不反应;
②______.
将图2中的铁片取出并洗净后,放入CuSO4溶液中,无明显现象,则说明假设①______(填“成立”或“不成立”)
(1)稀硝酸与铜反应生成硝酸铜、水和一氧化氮,反应的方程式为Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O,反应中硝酸起到氧化剂和酸性的作用,反应生成NO,为有毒气体,不能直接排放到空气中,用硝酸可起到收集气体的作用,另外可观察反应速率的快慢,
故答案为:Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O;HNO3;①观察反应速率的快慢②收集有毒气体,防止有毒气体散逸到空气中,污染空气;
(2)减缓反应速率,可降低温度、降低硝酸浓度,故答案为:降低反应体系的温度,降低硝酸的浓度;
(3)图2所示实验无明显现象,可能的情况有两种,一是没有反应,二是发生钝化反应,常温下,铁与浓HNO3反应表面生成一层致密的氧化膜,阻止里面的金属继续发生反应,如将图2中的铁片取出并洗净后,放入CuSO4溶液中,无明显现象,则说明假设①不成立,
故答案为:常温下,铁在浓HNO3中会“钝化”;不成立.
