(一)某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:
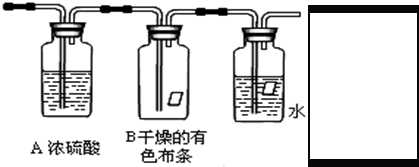
(1)浓硫酸的作用是______.
(2)B中观察到的实验现象是______.
(3)从物质性质方面来看,这样的实验设计还存在事故隐患,应如何处理,请画出装置图(填在上图内),用化学方程式表达原理______
(二)新制的氯水含有的分子和离子,现分别做如下实验:
将紫色石蕊试液滴入,溶液显红色,起作用的微粒是______.上述溶液逐渐褪去,起作用的微粒是______.
加入AgNO3溶液,有不溶于稀硝酸的白色沉淀生成,起作用的微粒是______.
(三)在标准状况下,35.5g氯气的体积是______L,将其与氢气完全化合,需氢气的物质的量是______mol,将生成的气体制成1L溶液,溶质的物质的量浓度是______mol•L-1,将此溶液取出20mL加蒸馏水稀释成200mL溶液,此稀稀后的溶液中溶质的物质的量浓度是______mol•L-1.
(一)(1)浓硫酸具有吸水性,常用作干燥剂,在实验中吸收气体a中的水蒸气,
故答案为:除去氯气中的水蒸气;
(2)干燥氯气不具有漂白性,装置B中的有色布条不褪色;
故答案为:不褪色;
(3)氯气有毒,应进行尾气处理,不能随意排放到空气中,可用碱溶液来吸收,方程式为Cl2+2NaOH=NaCl+NaClO+H2O,装置图为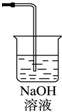 ;
;
故答案为: ;Cl2+2NaOH=NaCl+NaClO+H2O;
;Cl2+2NaOH=NaCl+NaClO+H2O;
(二)酸能使紫色石蕊试液变红色,在水溶液里电离出的阳离子全部是氢离子的是酸,所以使紫色石蕊试液变红色的微粒是氢离子;
次氯酸有漂白性,所以红色溶液逐渐褪色,起作用的微粒是次氯酸分子;
银离子和氯离子能生成不溶于稀硝酸的白色沉淀,所以加入AgNO3溶液,有不溶于稀硝酸的白色沉淀生成,起作用的粒子是氯离子.
故答案为:H+;HClO;Cl-;
(三)在标准状况下,35.5g氯气的体积是V=n×Vm=
×Vm=m M
×22.4L/mol=11.2L;35.5g 71g/mol
由H2~Cl2~2HCl可知n(H2)=n(Cl2 )=
=0.5mol;n(HCl)=2n(Cl2 )=1mol;35.5g 71g/mol
将生成的气体制成1L溶液,溶质的物质的量浓度是
=1mol/L;1mol 1L
设稀释后溶液的浓度为C,则1mol/L×20mL=C×200mL,解得:C=0.1mol/L;
故答案为:11.2;0.5;1;0.1.
