碳酸钙和硫酸钙都是钙的重要化合物,它们在生产生活中都有着广泛的应用.甲、乙两组同学分别对碳酸钙的制备、硫酸钙的性质进行了以下探究,请你参与并完成对有关问题的解答.
(1)甲组使用大理石(含少量的Fe2O3杂质)等物质制备碳酸钙的实验流程如图1:
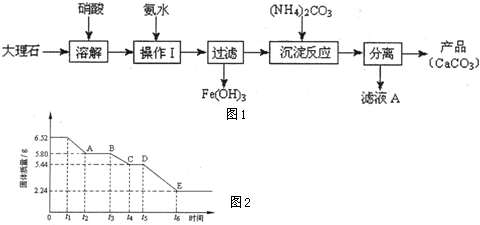
①溶解大理石时,用硝酸而不用硫酸的原因是______.
②上述流程中,“分离”得产品所包含的实验操作依次为:过滤、______、______.
③“滤液A”中除H+离子外,还含有的阳离子是______;检验该阳离子的实验方法是:取少量滤液A与______在试管中混合、加热充分反应,将湿润的红色石蕊试纸(或pH试纸)靠近试管口,观察现象即可.
(2)乙组对某硫酸钙晶体(xCaS04•yH20)加热分解的有关反应进行探究.他们取6.52g该晶体进行加热,加热过程中,固体质量随时间的变化情况如图2所示.又知t5~t6时间段内固体质量减轻的原因是产生了两种气体,反应的化学方程式为:2CasO4
2CaO+2S02↑+O2↑.加热 .
①加热时,该晶体开始发生化学变化的时间是______(填“t1”、“t3”或“t5”).
②t4~t5时间段固体的化学式为______.
③tl~t2时间段固体发生反应的化学方程式为______.
(1)①硫酸和碳酸钙反应生成的硫酸钙是微溶于水的物质,附着在大理石表面阻止反应进行,所以选择硝酸反应;
故答案为:硫酸钙微溶于水;
②上述流程中,“分离”得产品为碳酸钙沉淀和硝酸铵溶液,所包含的实验操作依次为过滤,洗涤,干燥;
故答案为:洗涤,干燥;
③大理石与硝酸反应后生成硝酸钙,硝酸铁,加入一水合氨反应生成氢氧化铁沉淀,滤液中加入碳酸铵反应生成碳酸钙沉淀,过滤得到碳酸钙,滤液中含有阳离子为氢离子,铵根离子;依据铵根离子的检验方法是和氢氧化钠反应生成氨气,遇到湿润的红色石蕊试纸变蓝证明氨气的生成;
故答案为:NH4+,烧碱;
(2)①依据图象分析,固体质量在0-t1时间段无变化,说明固体未反应,加热到t1时,固体质量开始减小,所以该晶体开始发生化学变化的时间是t1;
故答案为:t1;
②在加热到t1时xCaSO4•yH2O开始分解,t1~t2时间段和t3~t4时间段个固体的质量变化比较少,而t5~t6时间段固体质量变化较大,原因是t1~t2时间段生石膏脱去部分水,t3~t4时间段完全脱水,t4~t5时间段固体的化学式为CaSO4;
故答案为:CaSO4;
③t3~t4时间段完全脱水,则m(H2O)=6.52g-5.44g=1.08g,m(CaSO4)=5.44g,n(H2O)=
=0.06mol,n(CaSO4)=1.08g 18g/mol
=0.04mol,所以n(CaSO4):n(H2O)=x:y=0.04:0.06=2:3,化学式为:2CaSO4•3H2O,tl~t2时间段固体质量变化,减少水的质量=6.52g-5.80g=0.72g,n(H2O)=5.44g 136g/mol
=0.04mol;固体质量为5.80g,6.52g硫酸钙固体物质的量=0.72g 18g/mol
=0.02mol,则1mol2CaSO4•3H2O失水2mol,反应的化学方程式为:2CaSO4•3H2O6.52g 326g/mol
2CaSO4•H2O+2H2O,△ .
故答案为:2CaSO4•3H2O
2CaSO4•H2O+2H2O.△ .
