化学学习小组对某镁铝合金进行了如下实验研究,请你参与并完成对有关问题的解答.
实验药品:9.0g镁铝合金,100mLamol/L稀硫酸,260mL5mol/L氢氧化钠溶液.
实验步骤
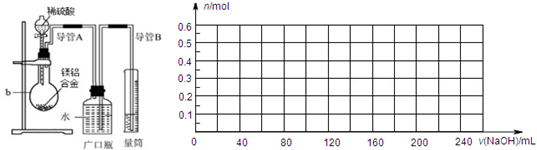
①将9.0g镁铝合金与100mLamol/L稀硫酸在图所示装置中充分反应至反应完毕,并收集生成的全部气体.
②向b内的混合液中逐滴加入260mL5mol/L氢氧化钠溶液并充分混合,当氢氧化钠溶液滴加至200mL时生成的沉淀量最大.
问题讨论
(1)仪器b的名称是______.
(2)根据实验目的可知,9.0g镁铝合金与100amol/L稀硫酸反应时,应该过(足)量的物质是______(填“镁铝合金”或“稀硫酸”),以保证另一种物质能够完全反应无剩余.
(3)实验步骤②中,当b内混合液中因滴加氢氧化钠溶液至生成的沉淀量最大时,此时所得溶液中的溶质是______.
(4)实验步骤①结束后,读取量筒所呈现的数据时,需要注意的三个主要问题是:一是要______,二是要调整量筒液面与广口瓶液面相平,三是要使视线与量筒内的凹液面相平.
(5)若标准状况下,由实验步骤①得到的气体体积为10.08L,则合金中镁的质量分数为______.
(6)在“amol/L稀硫酸”中a的值为______.
(7)请在图中画出实验步骤②中生成沉淀的物质的量(n)随加入氢氧化钠溶液的体积[v(NaOH)]的变化曲线.
(1)实验装置中用于硫酸和合金反应的容器是原地烧瓶,故答案为:圆底烧瓶;
(2)根据实验目的可知测定合金中镁铝的质量分数,实验式需要合金全部反应,所以需要稀硫酸过量,故答案为:稀硫酸;
(3)实验步骤②中,当b内混合液中因滴加氢氧化钠溶液至生成的沉淀量最大时发生的反应为:Mg+H2SO4=MgSO4+H2↑、2Al+3H2SO4=Al2(SO4)3+3H2↑、Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓;分析反应得到产生最大量测定后的溶质为Na2SO4,故答案为:Na2SO4;
(4)排水量气法需要注意水要冷却至室温,调整量筒液面与广口瓶液面相平,使视线与量筒内的凹液面相平,故答案为:冷却至室温;
(5)若标准状况下,由实验步骤①得到的气体体积为10.08L,依据反应计算:设镁物质的量为X,铝物质的量为Y;生成氢气物质的量=
=0.45mol;10.08L 22.4L/mol
Mg+H2SO4=MgSO4+H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑;
X X Y 1.5Y
X+1.5Y=0.45
24X+27Y=9
解方程得到:X=0.15mol;Y=0.2mol;
则镁的质量分数=
×100%=0.4,0.15mol×24g/mol 9.0g
故答案为:0.4;
(6)f反应过程中生成最大量沉淀时,依据化学方程式分析判断,相当于硫酸和氢氧化钠全部反应,依据氢离子和氢氧根离子物质的量相同列式:
100mLamol/L稀硫酸和200mL5mol/L氢氧化钠溶液恰好反应,0.1×a=0.2×5,a=5,故答案为:5;
(7)硫酸物质的量=0.1L×5mol/L=05mol;Mg+H2SO4=MgSO4+H2↑;2Al+3H2SO4=Al2(SO4)3+3H2↑;依据上述计算得到剩余硫酸=0.5mol-0.15mol-0.3mol=0.05mol,消耗氢氧化钠体积=
=0.02L=20ml;生成最大量测定需要氢氧化钠物质的量=0.15mol×2+0.2mol×3=0.9mol,消耗氢氧化钠溶液体积=0.05mol×2 5mol/L
=0.18l=180ml;沉淀氢氧化铝全部溶解发生反应:Al(OH0)3+OH-=AlO2-+2H2O;需要氢氧化钠物质的量为0.2mol,体积为40ml;共消耗氢氧化钠溶液体积=20ml+180ml+40ml=240mol;依据沉淀最大量为0.35mol;氢氧化镁沉淀为0.15mol;结合图象画法,描点画出图象为0.9mol 5mol/L
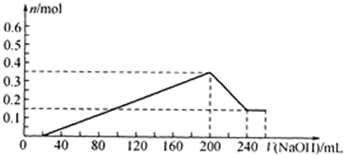 ,故答案为:
,故答案为: .
.
