MnCO3可用作电讯器材元件材料,还可用作瓷釉、颜料及制造锰盐的原料.实验室模拟以MnO2为原料生产MnCO3的工艺流程如图1: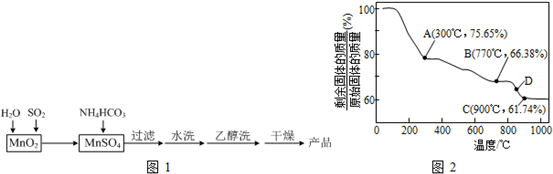
已知:MnCO3难溶于水和乙醇,受热易分解.
(1)实验室中过滤操作所用到的玻璃仪器有漏斗、烧杯、______.
(2)①检验水洗是否合格的方法是______.②水洗结束后,用乙醇洗涤的目的是______.
(3)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图2所示.则300℃时,剩余固体中n(Mn):n(O)为______;图中点D对应固体的成分为______(填化学式).
(1)过滤操作需要漏斗,玻璃棒,烧杯;
故答案为:玻璃棒;
(2)①分析流程可知,碳酸氢铵和硫酸锰反应生成碳酸锰沉淀,洗涤目的是洗去沉淀表面的硫酸根离子和铵根离子,设计方案为:取最后一次洗涤滤出液少许于一支试管中,向其中滴加盐酸酸化的氯化钡溶液,若无明显现象,说明水洗合格;
故答案为:取最后一次洗涤滤出液少许于一支试管中,向其中滴加盐酸酸化的氯化钡溶液,若无明显现象,说明水洗合格;
②水洗后,用乙醇洗涤,依据乙醇的性质分析,乙醇是易挥发的液体,操作中便于沉淀低温干燥,防止碳酸锰受热分解
故答案为:乙醇易挥发,便于低温干燥,防止MnCO3受热分解;
(3)设MnCO3的物质的量为1mol,即质量为115g
①A点剩余固体质量为115g×75.65%=87g
减少的质量为115g-87g=28g
可知MnCO3失去的组成为CO
故剩余固体的成分为MnO2
剩余固体中n(Mn):n(O)=1:2;
故答案为:1:2;
②C点剩余固体质量为115g×61.74%=71g
据锰元素守恒知m(Mn)=55g,则m(O)1=71g-55g=16g
则n(Mn):n(O)=
:55 55
=1:116 16
故剩余固体的成分为MnO
同理,B点剩余固体质量为115g×66.38%=76.337g
因m(Mn)=55g,则m(O)2=76.337g-55g=21.337g
则n(Mn):n(O)=
:55 55
=3:421.337 16
故剩余固体的成分为Mn3O4
因D点介于B、C之间,故D点对应固体的成分为Mn3O4与MnO的混合物;
故答案为:Mn3O4与MnO;
