工业纯碱中常常含有NaCl、Na2SO4等杂质.为粗略测定某工业纯碱的纯度,设计了如图所示的实验装置.依据实验设计,请回答:
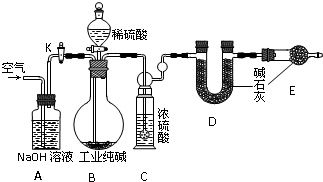
(1)装置B中盛装稀硫酸的仪器名称是______;B中发生反应的离子方程式为______.
(2)为达到实验目的,一次实验中至少应进行称量操作的次数为______.
(3)如果不用装置E,会导致实验结果______(填“偏高”、“偏低”或“无影响”).
(4)最后一次称量前,打开活塞K缓缓通入气体的目的是______.
(1)装置B中盛装稀硫酸的仪器名称是分液漏斗,B中碳酸钠与硫酸反应生成硫酸钠、水、二氧化碳,化学反应为Na2CO3+H2SO4=Na2SO4+CO2↑+H2O,离子反应为CO32-+2H+=CO2↑+H2O,故答案为:分液漏斗;CO32-+2H+=CO2↑+H2O;
(2)粗略测定某工业纯碱的纯度,需要纯碱的质量,反应生成二氧化碳的质量,测定D反应前后的质量,至少测定3次,故答案为:3;
(3)装置E可防止空气中的水、二氧化碳进入D中,使D中二氧化碳质量偏大,最后纯碱的含量偏高,故答案为:偏高;
(4)打开活塞K缓缓通入气体,将生成的二氧化碳气体赶入D中,即目的是使广口瓶中所有由Na2CO3产生的CO2都排出,故答案为:使广口瓶中所有由Na2CO3产生的CO2都排出.
