某学习小组按如图在实验室制取氨气并探究铜的有关性质(部分夹持仪器未画出).
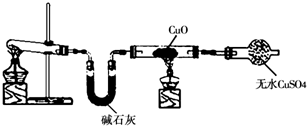
请回答:
(1)制取氨气的化学方程式是______.
(2)①实验现象为:黑色CuO变为红色(生成单质a);白色无水CuSO4粉末变为蓝色;同时生成一种无色气体,该气体无污染.请写出氨气与CuO反应的化学方程式______.②碱石灰的作用是______.
(3)将上述生成的单质a在热水浴中进行4个实验,部分实验报告如下表所示.
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 稀硫酸中加入该单质a | 无明显变化 |
| Ⅱ | 硝酸钠溶液中加入该单质a | 无明显变化 |
| Ⅲ | 硫酸钠溶液中加入该单质a | 无明显变化 |
| Ⅳ | 稀硫酸中加入硝酸钠溶液 | 无明显变化 |
| 再加入该单质a | 有无色气泡;溶液变蓝 |
②实验Ⅳ中反应的本质是(用离子方程式表示)______.
③将该单质a加入到混有硫酸的过氧化氢溶液中,溶液逐渐变成蓝色,该反应的离子方程式是______.
(1)氯化铵和氢氧化钙发生复分解反应,生成氯化钙和氨气和水,故答案为:Ca(OH)2+2NH4Cl
CaCl2+2H2O+2NH3↑;△ .
(2)①根据实验现象判断生成物,能使白色无水硫酸铜粉末变为蓝色的物质是水,黑色的氧化铜变为红色的物质是铜(类比氢气还原氧化铜),根据氧化还原反应得,该无色无污染的气体是氮气,故答案为:3CuO+2NH3
3Cu+N2+3H2O;△ .
②碱石灰的成分是 CaO和NaOH的混合物,CaO能和水反应,NaOH易潮解,所以能作干燥剂,
故答案为:吸收氨气中混有的水蒸气,防止干扰产物水的鉴定;
(3)①根据实验现象知,钠离子、硫酸根离子、硝酸根离子均不能单独使铜溶解,所以实验Ⅰ、Ⅱ、Ⅲ是证明铜和氢离子、钠离子、硫酸根离子和硝酸根离子都不反应,
故答案为:说明钠离子、硫酸根离子、硝酸根离子均不能单独使铜溶解;
②酸性条件下,铜和硝酸根离子发生氧化还原反应生成铜离子、一氧化氮气体和水,离子反应方程式为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O,故答案为:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O;
③酸性条件下,向稀硫酸中加入铜后溶液变蓝色,说明铜被氧化生成铜离子,则双氧水被还原生成水,离子方程式为:Cu+2H++H2O2=Cu2++2H2O,故答案为:Cu+2H++H2O2=Cu2++2H2O.
