问题
计算题
请根据下列实验数据确定某水合物含Fe2+的盐的化学式。
(1)将0.784 g该含亚铁的盐强烈加热至质量恒定,得到0.160 g Fe2O3;
(2)将0.784 g该盐溶于水,加入过量的BaCl2溶液,得到0.932 g BaSO4;
(3)0.392 g该盐溶于水,加入过量的NaOH溶液后煮沸,释放出的氨气用50.0 mL 0.10 mol·L-1盐酸吸收后,吸收液需要30.0 mL 0.10 mol·L-1NaOH溶液恰好中和。
答案
(NH4)2Fe(SO4)2·6H2O
0.784 g盐所含Fe2+、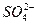 、
、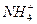 、H2O的物质的量分别是:
、H2O的物质的量分别是:
n(Fe2+)=(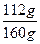 ×0.160 g)÷56 g·mol-1="0.002" mol
×0.160 g)÷56 g·mol-1="0.002" mol
n(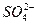 )=
)=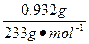 ="0.004" mol
="0.004" mol
n(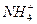 )="(50.0" mL-30.0 mL)×10-3L·mL-1×0.10 mol·L-1×
)="(50.0" mL-30.0 mL)×10-3L·mL-1×0.10 mol·L-1×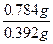 =0.004mol
=0.004mol
n(H2O)=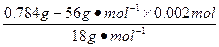 -
-
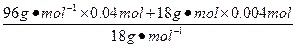
="0.012" mol
n(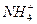 )∶n(Fe2+)∶n(
)∶n(Fe2+)∶n(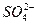 )∶n(H2O)=
)∶n(H2O)=
0.004 mol∶0.002 mol∶0.004 mol∶0.012 mol=2∶1∶2∶6
所以该盐的化学式为(NH4)2Fe(SO4)2·6H2O
