(15分)
阅读分析材料,据此完成下列要求。
工业纯碱中常含有少量的NaCl和NaOH。某校课外活动小组的同学为测定纯碱样品中
Na2CO3的质量分数,选择下列适当装置进行连接,并对设计方案不断完善,成功完成了
测定实验。
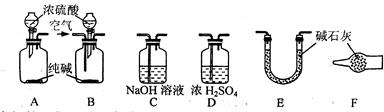 |
⑴活动小组的五位同学对实验装置的设计进行了讨论发言,内容如下:
甲:将装置A和E连接即可。因为Na2CO3与稀硫酸反应生成的CO2被E中的碱石灰吸收,分别测量反应前和反应后E的总质量,就可求出Na2CO3的质量分数。
乙:还应在A和E之间连接装置 (填序号),其目的是 。
丙:应该用B装置取代A装置。从B装置的导管口处缓慢鼓入空气,其目的是 。
丁:若直接向B装置中鼓入空气会导致实验测定结果 (填“偏高”、“偏低”或
“无影响”),因此,应将鼓入的空气先通过装置 (填序号)。
戊:E装置后还应连接装置F,其作用是 。
⑵学生课外活动小组测定的数据如下,计算该工业纯碱中Na2CO3的质量分数为 。
| 工业纯碱样品质量 | 反应前E的总质量 | 反应后E的总质量 |
| 6.4g | 51.9g | 54.1g |
(1)D(1分) 除去水(2分) 使二氧化碳充分排除以利于完全吸收(2分)
偏高(1分) C(1分) 防止空气中的二氧化碳和水蒸气进入E装置,影响测定结果(3分)
(2)82.8% (3分)
(3)用托盘天平称取一定质量的样品(m1)于烧杯中,加适量蒸馏溶解,加入足量的BaCl2溶液至不再产生沉淀为止,过滤、洗涤、烘干,称取沉淀的质量(m2),由m1和m2计算出Na2CO3的质量分数(3分)
涉及到仪器的组装,实验方案的评价,误差分析,及简单的计算和实验方案的设计,本题与2005年全国卷I实验类似,又有创新,值得分析一下,体会命题意图
