(14分)实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如下图所示:
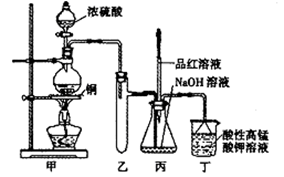
请回答:
(1)实验中取一定量Cu片和一定量浓H2SO4放在圆底烧瓶中共热,至反应结束后,发现烧瓶中还有少量Cu剩余,有人认为还有一定量的H2SO4剩余,原因是
,在不增加浓H2SO4的前提下,若使剩余铜片溶解可再加入 (填写两种属于不同类别的物质)。
(2)向反应后的溶液中加入足量的CuO,使剩余的H2SO4全部转化为CuSO4,过滤后将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4·XH2O)某小组同学采用加热法测定该晶体里结晶水X的值;
①在他们的实验操作中至少称量 次。
②下面是其中一次实验的数据
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
(3)装置乙的作用是: ;
(4)下列说法正确的是: (填序号)。
a.甲装置使用的玻璃仪器有:酒精灯、玻璃管、长颈漏斗、圆底烧瓶
b.KMnO4溶液用于尾气处理
c.当把品红溶液滴入到锥形瓶中,若品红不褪色,说明无NaHSO3产生
d.当把品红溶液滴入到锥形瓶中,若品红褪色,说明NaOH已完全转化为NaHSO3
e.若把品红溶液换成酸性高锰酸钾溶液,并滴入到锥形瓶中,不显紫红色,说明NaOH已完全转化为NaHSO3
f.此装置换上其它药品后,不能制取和收集少量纯净的氯气
(1)稀H2SO4与Cu不反应,随着反应进行,H2SO4越来越稀,所以H2SO4一定有剩余(2分)NaNO3(1分)Fe2O3(1分)(其他合理答案均可) (2)①4 ②偏大(每空2分)
(3)防止丙中液体倒吸入甲中(3分) (4)b d f(3分)
解析:(2)根据有关数据可计算出X的实测值比5大,实验中产生的误差使实测值偏大。
(3)装置乙主要是防止倒吸。
(4)溶液中如果溶有SO2则品红褪色若无SO2则不褪色,但并不能说明无NaHSO2。
(1)稀H2SO4与Cu不反应,随着反应进行,H2SO4越来越稀,所以H2SO4一定有剩余;在不增加浓H2SO4的前提下,若使剩余铜片溶解可再加入硝酸、硝酸钠、氧化铁等均可。
(2)①在他们的实验操作中至少称量4次,分别为坩埚质量、坩埚和样品质量、灼烧后坩埚和样品质量、再灼烧后坩埚和样品质量。
②偏大
(3)装置乙的作用是:安全瓶,防止倒吸。
(4)a 错误,不是长颈漏斗,是分液漏斗。
b 正确,二氧化硫跟KMnO4反应,所以KMnO4溶液用于尾气处理
c 错误,二氧化硫能使品红褪色,NaHSO3没有这种性质。所以,品红褪色与否,与NaHSO3没有关系。
d 正确,品红褪色,说明二氧化硫过量,NaOH不足,已完全转化为NaHSO3
e 错误,改为高锰酸钾,高锰酸钾不仅能和二氧化硫反应,也能和NaHSO3反应,高锰酸钾,不能说明NaOH是否反应彻底。
f.正确,此装置换上其它药品后,不能收集少量纯净的氯气。
故选b d f。
