问题
实验题
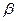 —锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
—锂辉石的主要成分是Li2O·Al2O3·4SiO2,还含有FeO、CaO、MgO等。
以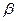 —锂辉石为原料制备碳酸锂的一种流程如下:
—锂辉石为原料制备碳酸锂的一种流程如下:
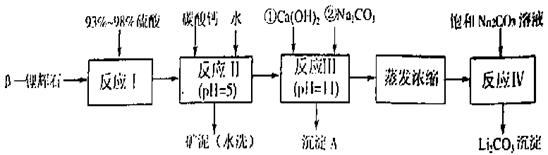
已知:①部分金属氢氧化物开始沉淀和完全沉淀的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)反应II中加碳酸钙的作用是 。
(2)写出反应III中生成沉淀A的离子方程式 、 。
(3)写出反应IV的化学方程式 。洗涤所得Li2CO3沉淀要用热水而非冷水,原因是 。
(4)实验室中常用于蒸发浓缩的硅酸盐质的仪器有______________。
A.蒸发皿
B.玻璃棒
C.铁架台(带铁圈)
D.酒精灯 E、圆底烧瓶
答案
(1)除去反应Ⅰ中过量的硫酸,控制pH使Fe 3+、Al3+完全沉淀(3分)
(2)Mg2++2OH-= Mg(OH)2↓(2分) Ca2++CO32-=CaCO3↓(2分)
(3)Li2SO4+Na2CO3=Li2CO3↓+Na2SO4(3分)
碳酸锂在较高温度下溶解度小,用热水洗涤可减少碳酸锂的损耗(3分)
(4)ABD(3分)
