(15分)硫酸亚铁铵(NH4)2SO4?FeSO4?6H2O是一种重要化学试剂。某探究性学习小组用除去锌镀层的铁片来制取硫酸亚铁铵,设计流程如下:
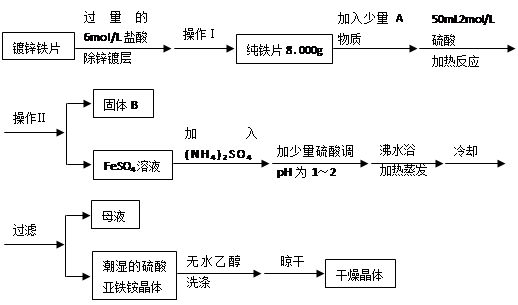
请回答下列问题:
(1)确定锌镀层被除去的标志是 ;
计算上述铁片锌镀层的厚度,不需要的数据是 (填编号)。
a.锌的密度ρ(g/cm3) b.镀锌铁片质量m 1(g) c.纯铁片质量m 2(g)
d.镀锌铁片面积S(cm2) e.镀锌铁片厚度h(cm)
锌镀层的厚度为 cm(用含ρ、m 1、m 2…等的代数式表示)。
(2)上述流程中:操作Ⅰ是取出铁片、 、 、称量;操作Ⅱ是 。
(3)A物质可以为 (填编号)。
a.CuCl2 b.CuO c.Cu(NO3)2 d.CuSO4
加入少量A物质的目的是 ,B物质的成分为 。
(4)加少量硫酸调节pH为 1~2的目的是 。
(5)用无水乙醇洗涤潮湿的硫酸亚铁铵晶体是为了除去晶体表面残留的水分,不用加热烘干的原因是 。
(6)鉴定所得晶体中含有Fe2+、NH4+、SO42―离子的实验方法正确的是 (填编号)。
a.取少量样品于试管,加水溶解,通入适量Cl2,再加KSCN溶液,观察现象
b.取少量样品于试管,加水溶解,加入NaOH溶液,露置于空气中,观察现象
c.取少量样品于试管,加水溶解,加入稀NaOH溶液,用湿润的红色石蕊试纸置于试管口,观察试纸颜色的变化
d.取少量样品于试管,加水溶解,加入盐酸后再加入BaCl2溶液,观察现象
(1)反应速率突然减小(或铁片表面生成的气泡突然减少)(1分)
e (1分)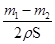 (2分)
(2分)
(2)洗涤、烘干(或干燥)(1分,有错不得分)过滤(1分)
(3)b、d(各1分,共2分),加快铁片与硫酸的反应速率(2分),
Fe和Cu(1分,有缺不得分)
(4)抑制Fe2+、NH4+水解(1分)(5)避免加热过程中晶体受热分解(或被氧化)(1分)
(6)b、d(各1分,共2分)
(1)两金属均可置换出氢气,但锌的金属活性较铁强,故当铁片表面生成的气泡突然减少时,表明锌镀层已被除去
锌层的质量为 ,其体积为
,其体积为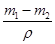 ,由于锌层为两面,故锌层厚度为
,由于锌层为两面,故锌层厚度为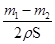 ,故计算锌镀层的厚度不需要“镀锌铁片厚度”
,故计算锌镀层的厚度不需要“镀锌铁片厚度”
(2)操作I:为了提高实验精度,必须将铁片表面洗涤干净,再干燥后称量
操作II:将不溶于水的固体与溶液分离应采用过滤的方法
(3)由于原电池反应速率快于化学反应,同时为不引入杂质,故可通过加入CuO或CuSO4形成铁铜原电池,以加快反应速率
B物质是过量的铁及置换出铜
(4)由于Fe2+、NH4+均水解呈酸性,为抑制其水解,需使溶液呈酸性,调节pH为1~2
(5)由于产品易分解并且易被氧化,故尽量不加热
(6)a:即使不含有Fe2+,最终也可出现血红色,不正确
b:通过生成白色沉淀及沉淀颜色的变化,可检验出Fe2+的存在,正确
c:由氨气极易溶于水,没有加热操作,气体不能逸出,试纸不会变色,不正确
d:可以检验出SO42―离子的存在,正确
