问题
实验题
(16分)某同学为测定黄铜矿的纯度(主要成分CuFeS2含少量SiO2),设计如下实验:称取2.0g研细的该黄铜矿样品,高温下和空气中的氧气充分反应:
 6CuFeS2+19O2
6CuFeS2+19O2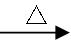 6CuO+2Fe3O4+12SO2
6CuO+2Fe3O4+12SO2
生成的SO2进入D中和水发生反应:SO2+H2O=H2SO3;
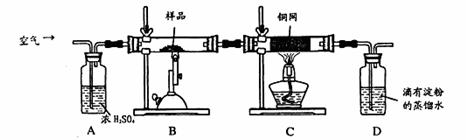
(1)称量该样品时用的仪器的名称为 。
(2)装置A的作用 ;
a.有利于空气中氧 气充分反应 b.除去空气中的水份
气充分反应 b.除去空气中的水份
c.有利于气体混合 d.有利于观察空气流速
(3)装置B中反应结束后,仍需继续通一段时间空气的目的 。
(4)实验后将D中的溶液全部转移至锥形瓶,用1.0mol/L的I2溶液进行滴定,反应为:H2SO3+I2 +H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为 ,通过计算,该黄铜矿的纯度为 (Cu:64 Fe:56 S:32)
+H2O=H2SO4+2HI,达到终点时消耗I2溶液20.00mL,判断滴定达到终点的现象为 ,通过计算,该黄铜矿的纯度为 (Cu:64 Fe:56 S:32)
答案
(1)托盘天平(2分)
(2)b、d(4分,只选一个对的得2分,全对得4分,其它有错的答法不得分)
(3)使生成SO2全部进入 装置,使结果准确(2分)。除去B中多余的O2,防止其氧化D中生成的H2SO3(2分)
装置,使结果准确(2分)。除去B中多余的O2,防止其氧化D中生成的H2SO3(2分)
(4)溶液恰好由无色变成浅蓝色(2分),且半分钟内不褪色(1分) 9 2%(3分)
2%(3分)
